
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液,该混合溶液中NaCl的物质的量浓度为 mol/L。
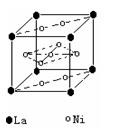
(2)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。右图为该合金的晶体结构中最小的重复结构单元,其中心有一个镍原子,其他镍原子都在面上,镧原子都在顶点上。该晶体的化学式为 。
(3)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属镁将水体中的NO![]() 还原为N2,从而消除污染。
还原为N2,从而消除污染。
①写出镁和含氮废水反应的离子方程式 ;
②上述反应中,生成标准状况下33.6L氮气时,转移电子的物质的量为 mol。③已知金属镁可以从海水中提取的MgCI2通过电解制得的,若要除去含氮元素0.3mol的废水中的NO![]() ,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
查看答案和解析>>
科目:高中化学 来源:2012届广东省潮阳一中明光学校高三入学理科综合化学试卷 题型:计算题
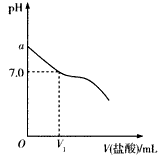
(16分)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH值的变化关系如右图所示。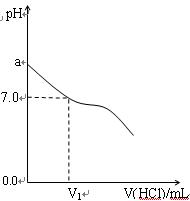
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值
刚好为7.0。此时溶液中c(Cl-) c(CH3COOH)
(填<、>或=)。简要写出判断依据
。
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka(设混合后的体积为二者的体积之和,计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省明光学校高三入学理科综合化学试卷 题型:综合题
(16分)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH值的变化关系如右图所示。
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值
刚好为7.0。此时溶液中c(Cl-) c(CH3COOH)
(填<、>或=)。简要写出判断依据
。
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka(设混合后的体积为二者的体积之和,计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省高三高考前最后模拟试卷(理综)化学部分 题型:填空题
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的Ph值的变化关系如右图所示。

(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值刚好为7.0。此时溶液中c(Cl-) c(CH3COOH)(填<、>或=)。简要写出判断依据
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COH的电离平衡常数Ka(计算结果保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com