
| A. | 离子化合物Y(XO3)2 | B. | 离子化合物Y2X3 | C. | 共价化合物Y3X2 | D. | 共价化合物XY2 |
分析 X元素的L层比Y元素的L层少3个电子,说明X的L层电子数小于8,应为第二周期元素,X元素原子的核外电子总数比Y元素原子的核外电子总数少5个,说明Y应含有M层电子,则X原子的最外层电子数为8-3=5,故X为N元素,Y元素原子核外电子数为7+5=12,故Y为Mg元素,以此解答该题.
解答 解:X元素的L层比Y元素的L层少3个电子,说明X的L层电子数小于8,应为第二周期元素,X元素原子的核外电子总数比Y元素原子的核外电子总数少5个,说明Y应含有M层电子,则X原子的最外层电子数为8-3=5,故X为N元素,Y元素原子核外电子数为7+5=12,故Y为Mg元素,
A.Y为Mg、X为N,Mg元素可以形成硝酸盐Mg(NO3)2,属于离子化合物,故A正确;
B.Mg元素与氮元素可以形成离子化合物Mg3N2,故B错误;
C.Mg3N2为离子化合物,不是共价化合物,故C错误;
D.N和Mg形成的为离子化合物Mg3N2,故D错误;
故选A.
点评 本题考查原子结构与元素性质知识,题目难度不大,为高考常见题型,推断元素为解答关键,试题侧重于学生的分析能力和推断能力的考查,注意把握元素结构的特点和规律.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氯气和消石灰反应可以制得漂粉精 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 用氧化钠作为呼吸面具和潜水艇的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 0.5mol•L-1H2SO4溶液 | B. | 35mL 0.6mol•L-1 Al2(SO4)3溶液 | ||
| C. | 70mL 0.8 mol•L-1NaCl溶液 | D. | 60mL 0.7 mol•L-1 Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
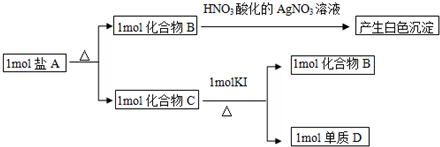
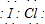 ,该化合物中显正价的是I元素.
,该化合物中显正价的是I元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 增大压强可以提高HCl转化率 | |
| D. | 平衡常数K(200℃)<K(400℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2O${\;}_{2}^{2-}$═4OH-+18O2↑ | |
| B. | 向0.1 mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液SO42-使完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
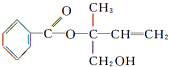
| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | 若单键可以旋转,有机物X中一定在同一平面上的碳原子数为8 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中 Cl2+H2O?H++Cl-+HClO | |
| B. | 甲烷的完全燃烧CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$ CO2(g)+2H2O(l)△H<0 | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应 2Fe+3H2O$\frac{\underline{\;高温\;}}{\;}$ Fe2O3+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com