
| A. | 沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 等物质的量的物质完全燃烧时耗O2量:乙烷>乙烯>甲烷 | |
| D. | 等质量的物质完全燃烧时耗O2量:甲烷>乙烷>乙烯>乙炔 |
分析 A.烷烃中,碳原子个数越多其熔沸点越高,碳原子个数相等的问题,支链越多其熔沸点越低;
B.分子晶体中,相对分子质量越大,其密度越大,但水的密度大于苯;
C.设有机物的化学式为CxHyOz,等物质的量的有机物其耗氧量:(x+$\frac{y}{4}$-$\frac{z}{2}$);
D.若烃为CxHy,同质量的物质燃烧耗O2量为$\frac{m}{M}$×(x+$\frac{y}{4}$).
解答 解:A.烷烃中,碳原子个数越多其熔沸点越高,碳原子个数相等的问题,支链越多其熔沸点越低,所以沸点:2,2一二甲基戊烷>2,3一二甲基丁烷>戊烷>丙烷,故A错误;
B.分子晶体中,相对分子质量越大,其密度越大,但水的密度大于苯,所以密度:CCl4>CHCl3>H2O>苯,故B正确;
C.设有机物的化学式为CxHyOz,等物质的量的有机物其耗氧量:(x+$\frac{y}{4}$-$\frac{z}{2}$),所以同物质的量物质燃烧耗O2量:乙烷>乙烯>甲烷,故C正确;
D.若烃为CxHy,同质量的物质燃烧耗O2量为$\frac{m}{M}$×(x+$\frac{y}{4}$),显然甲烷消耗氧气最多,大小顺序为甲烷>乙烷>乙烯>乙炔,故D正确;
故选A.
点评 本题考查学生利用燃烧通式的计算及物理性质的比较,注意规律的应用是解答本题的关键,要求学生学会归纳总结,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
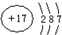 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024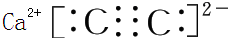
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
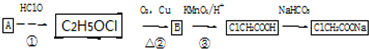
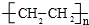 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOD,C2H5OD | B. | CH3COONa,C2H5OD,HOD | ||
| C. | CH3COONa,C2H5OH,HOD | D. | CH3COONa,C2H5OD,H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=0.5,当Cu2+在阴极恰好全部析出时,产生的气体只有氯气 | |
| B. | 若a=0.5,当Cu2+在阴极恰好全部析出时,产生的气体的物质的量为0.1mol | |
| C. | 若a=0.2,当Cl-在阳极恰好全部逸出时,产生0.08mol的NaOH | |
| D. | 若电解一段时间后,阴、阳两极产生的气体的物质的量恰好均为0.16mol,则a=0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1的硫酸铝溶液中含有的Al3+为2NA | |
| B. | pH=1的H2SO4溶液中含有H+的数目为0.2NA | |
| C. | 常温下5.6 g Fe与足量的浓硝酸反应,转移电子的数目为0.3NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应,转移电子的数目均为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com