
| A.根据相似相溶原理,利用CCl4萃取溴水中的Br2 |
| B.Na2CO3与CaCO3都是电解质,但Na2CO3在相同温度下溶解度更大 |
| C.卤化氢都易溶于水,且都得到强酸性溶液 |
| D.乙酸与甲酸甲酯(HCOOCH3)互为同分异构体,乙酸比甲酸甲酯易溶于水 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨分子中两个氢原子间的距离 |
| B.氯分子中两个氯原子间的距离 |
| C.金刚石晶体中任意两个相邻的碳原子核间的距离 |
| D.氯化钠晶体中相邻的氯离子和钠离子核间的距离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BeCl2中的Be,sp,直线形 |
| B.SiF4中的Si,sp3,正四面体形 |
| C.BCl3中的B,sp2,平面三角形 |
| D.C6H6中的C,sp,平面正六边形 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | ⑦ | | | | | | | | | | | | | | | ⑧ | |
| | | | | | ⑨ | | | | | ⑩ | | | | | | | |
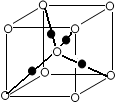
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由分子间作用力结合而成,熔点低 |
| B.固体或熔融后易导电,熔点在1000℃左右 |
| C.由共价键结合成网状结构,熔点高 |
| D.固体不导电,但溶于水或熔融后能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com