
| A. | 25℃时,0.1mol•L-1HF 溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 加入CaCl2溶液后体系中的c(H+)不变 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
分析 A.HF酸为弱酸,不能完全电离;
B.Ksp只与温度有关;
C.加入CaCl2溶液,溶液中c(Ca2+)、c(F-)变化,则影响HF的电离平衡移动;
D.Qc>Ksp,说明有沉淀产生.
解答 解:A.HF酸为弱酸,不能完全电离,则25℃时,0.1 mol•L-1HF溶液中pH>1,故A错误;
B.Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故B错误;
C.加入CaCl2溶液,溶液中c(Ca2+)、c(F-)变化,则影响HF的电离平衡移动,则c(H+)变化,故C错误;
D.两溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{Ka×c(HF)}$=6×10-3mol/L,则Qc=c2(F-)•c(Ca2+)=(6×10-3mol/L)•0.1 mol•L-1=6×10-4>Ksp,说明有沉淀产生,故D正确;
故选D.
点评 本题考查平衡常数及沉淀的生成,为高频考点,侧重考查学生的分析、计算能力,注意利用溶度积判断沉淀能否生成,把握影响平衡常数的因素即可解答,题目难度中等.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2>I->Fe2+ | B. | I->Fe2+>SO2 | C. | Fe2+>I->SO2 | D. | Fe2+>SO2>I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 铁屑在稀H2SO4作用下产生H2Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
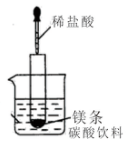 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有 Ag2S 也有 AgCl | ||
| C. | 不能由黑色沉淀转变为白色沉淀 | D. | 只有 AgCl 白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com