
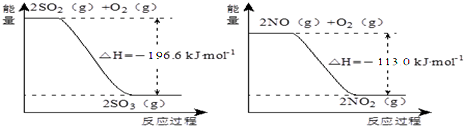
 ,故答案为:
,故答案为: ;
;| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
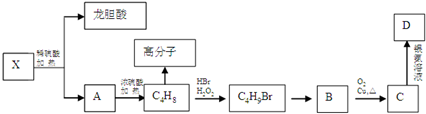
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇分子可以看作是乙烷分子中的一个氢原子被-OH取代而形成的 |
| B、乙醇分子中的氢原子都可以被钠置换 |
| C、-OH和OH-两种微粒中质子数、电子数都相等 |
| D、水和乙醇分子中的羟基化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、选煤厂溶剂萃取脱硫 |
| B、煤的气化(产物主要为CO和H2) |
| C、将煤在氢气和催化剂作用下通过加氢裂化转变为液体燃料的过程 |
| D、发电厂用燃煤发电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| AgCl | Ag2CrO4 | AgI | |
| 颜色 | 白 | 砖红 | 黄 |
| Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
| A、AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减弱 |
| B、Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol?L-1 |
| C、向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色 |
| D、向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔融状态下能够导电的化合物中一定存在离子键 |
| B、单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |
| C、L层上的电子数为奇数的原子一定是主族元素的原子 |
| D、同一主族的元素的原子,最外层电子数相同,化学性质不一定完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com