
| 物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
| 熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
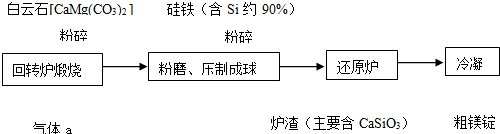
分析 Ⅰ.(1)金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.
金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来(Hg及后边金属);
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来(Zn~Cu);
合电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属(K~Al);
(2)氧化镁熔点比氯化镁熔点高,熔融离子晶体要消耗能源;氯化铝是共价化合物,熔融状态下不导电;
(3)铝热法冶炼锰是铝和二氧化锰高温反应生成锰和氧化铝;使用铝热法冶炼的金属需要满足金属熔点高于铝,金属活泼性小于铝;
Ⅱ.白云石回转炉中粉碎后煅烧得到气体a为二氧化碳,固体为钙、镁的氧化物,粉碎加入硅铁粉磨,压制成球,进入还原炉发生反应,硅还原氧化镁生成的二氧化硅和氧化钙反应生成硅酸钙炉渣,冷凝得到粗镁锭,
(1)分析可知气体a为二氧化碳;
(2)白云石煅烧前粉碎的目的是,加快反应速率;
(3)还原炉中发生的主要反应有硅还原氧化镁生成镁和二氧化硅,二氧化硅和氧化钙形成炉渣硅酸钙;
(4)还原炉中抽空气到近似真空是防止生成的金属镁被空气中氧气氧化;
解答 解:Ⅰ.(1)金属冶炼是工业增大接触面积,加快反应上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法,影响金属冶炼方法的首要因素是金属的活泼性,故答案为:金属的活泼性;
(2)氧化镁熔点比氯化镁熔点高,熔融离子晶体要消耗能源,从而增加成本,为减少成本,所以用熔融氯化镁冶炼镁,氯化铝是共价化合物,熔融状态下不导电,以分子存在,所以冶炼铝用熔融氧化铝,
故答案为:MgO的熔点比MgCl2的熔点高,MgO熔融时耗费更多能源,增加成本;AlCl3属于共价化合物,熔融状态下不导电,故不能电解AlCl3;(3)铝热法冶炼锰的化学方程式:4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,一般使用铝热法冶炼的金属具有的性质为:熔点高且比铝不活泼的金属,
故答案为:4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn;熔点高且比铝不活泼的金属;
Ⅱ.(1)白云石煅烧分解生成氧化钙、氧化镁和二氧化碳,气体为二氧化碳,
故答案为:CO2;
(2)白云石煅烧前粉碎的目的是增大固体表面积,提高反应速率,
故答案为:增大固体表面积,提高反应速率;
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空,还原炉中发生的主要反应有硅还原氧化镁生成镁和二氧化硅,二氧化硅和氧化钙形成炉渣硅酸钙,反应的化学方程式为:2MgO+Si$\frac{\underline{\;高温\;}}{\;}$2Mg↑+SiO2;SiO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSiO3,
故答案为:2MgO+Si$\frac{\underline{\;高温\;}}{\;}$2Mg↑+SiO2;SiO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSiO3;
(4)还原炉中抽空气到近似真空的原因是防止已还原的Mg在高温条件下再次被氧化,
故答案为:防止已还原的Mg在高温条件下再次被氧化.
点评 本题考查了金属冶炼的方法、原理和注意问题,主要是铝热反应、热还原方法制备金属,化学方程式书写,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇和二甲醚的分子式相同,结构不同 | |
| B. | 乙醇和二甲醚的物理性质不同,化学性质相同 | |
| C. | 二者完全燃烧后的产物相同 | |
| D. | 1mol二甲醚分子中含有8NA共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

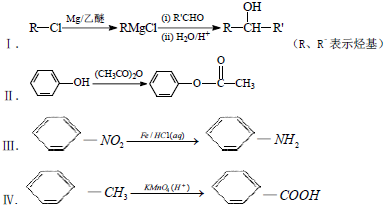
 .
. .
. ,
,查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
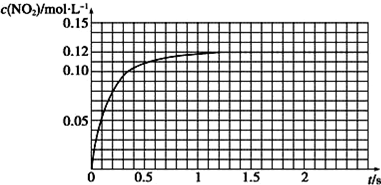
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g Fe参与反应转移的电子数一定为0.2NA | |
| B. | 2.3g Na参与反应转移的电子数一定为0.1NA | |
| C. | 标况下,2.24L Cl2参与反应转移的电子数一定为0.2NA | |
| D. | 标况下,2.24L O2参与反应转移的电子数一定为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com