
【题目】Ⅰ.下列气体的制备和性质实验中,由现象得出的结论正确的是________
选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
B | 浓盐酸、浓硫酸 | 蓝色石蕊试纸 | 变红 | HCl为酸性气体 |
C | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
D | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
Ⅱ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3, NH4HCO3很容易分解。 2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00LNaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为__________________(填浓度范围)。
(3)CO2和 KO2 有下列反应:4KO2+2CO2=2K2CO3+3O2
4KO2+4CO2+2H2O=4K2HCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的物质的量应该是______________。
【答案】 ABD 89.6 1.2mol/L≤c≤2.4mol/L 3mol
【解析】(1)碳酸氢铵分解的化学方程式为:NH4HCO3![]() H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。(2)根据题意要求,2.40 molCO2被完全吸收,NaOH也完全反应,则反应的产物可能是Na2CO3(此时NaOH的浓度最大)或NaHCO3(此时NaOH的浓度最小)或Na2CO3和NaHCO3的混合物。用极值思想分析两个特殊情况:①CO2+NaOH=NaHCO3,n(NaOH)= n(CO2)=2.40mol,则c(NaOH)=
H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。(2)根据题意要求,2.40 molCO2被完全吸收,NaOH也完全反应,则反应的产物可能是Na2CO3(此时NaOH的浓度最大)或NaHCO3(此时NaOH的浓度最小)或Na2CO3和NaHCO3的混合物。用极值思想分析两个特殊情况:①CO2+NaOH=NaHCO3,n(NaOH)= n(CO2)=2.40mol,则c(NaOH)= ![]() =1.20mol/L;②CO2+2NaOH=Na2CO3+H2O,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=
=1.20mol/L;②CO2+2NaOH=Na2CO3+H2O,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=![]() =2.40mol/L;综合①、②可知,NaOH溶液的浓度应该为1.20mol/L≤c(NaOH)≤2.40mol/L。(3)方法一:依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:8KO2+6CO2+2H2O=2K2CO3+4KHCO3+6O2,所以有n(H2O)=
=2.40mol/L;综合①、②可知,NaOH溶液的浓度应该为1.20mol/L≤c(NaOH)≤2.40mol/L。(3)方法一:依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:8KO2+6CO2+2H2O=2K2CO3+4KHCO3+6O2,所以有n(H2O)=![]() n(CO2)=
n(CO2)=![]() ×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。方法二:设反应前密封舱内H2O的物质的量为n
×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。方法二:设反应前密封舱内H2O的物质的量为n
4KO2 + 4CO2 + 2H2O=4KHCO3 + 3O2
2n 1.5n
4KO2 + 2CO2=2K2CO3 + 3O2
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+ 1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内
H2O的物质的量为3mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是( )

A. 实验Ⅰ:实验室制备氨气 B. 实验Ⅱ:用二氧化碳作喷泉实验
C. 实验Ⅲ:进行中和热的测定 D. 实验Ⅳ:电解氯化铜溶液得到铜和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述中,正确的是( )
A.为防止钠与水反应时燃烧,可将该反应置于试管中进行,以减少与氧气的接触
B.钠着火时应用干燥的沙土灭火
C.钠在空气中受热时,熔化为银白色的小球,产生黄色的火焰,生成白色粉末
D.钠在空气中长期放置,最终主要生成物为过氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是
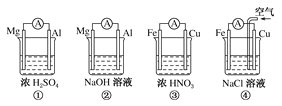
A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其淸如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A. 萃取 B. 渗析 C. 蒸馏 D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物X 的路线如下:
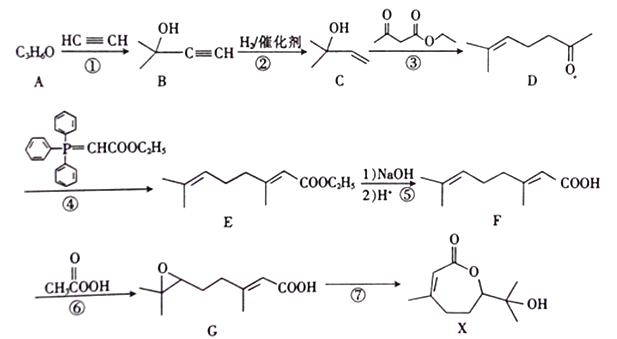
(1)X中含氧官能团的名称为________;A的核磁共振氢谱只有一组吸收峰,A的结构简式为____________。
(2)反应①的反应类型为_________。反应①还会得到另一产物H,其分子式为C8H14O2,写出H的结构简式:______________。
(3)反应⑥的产物为G和_________(填结构简式)。
(4)X分子消去一分子水可得物质J,同时满足下列条件的J的同分异构体共有_____种。其中核磁共振氢谱只有六组吸收峰的同分异构体与足量浓溴水反应的化学方程式为__________。
a.能与FeCl3溶液发生显色反应
b.能发生消去反应
c.苯环上只有2个取代基,且分子中只有2个甲基
(5)参照上述合成路线,设计一条以CH3OH、CH≡CH为原料制备聚丙烯醇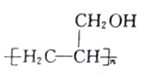 的合成路线图(无机试剂任用)。合成路线示例如下:_______________
的合成路线图(无机试剂任用)。合成路线示例如下:_______________
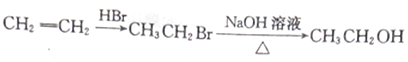
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在某温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g)
NH3(g)+HI(g)
②2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
当反应达到平衡时,cH2=0.5 mol / L,cHI=4 mol / L,则反应①的化学平衡常数为 ( )
A.10 B.15 C.20 D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系右图所示,其中反应条件和某些产物己经略去:
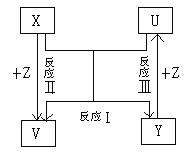
(1)如果X、Y的组成元素是同主族的。
①若已知V是水:写出反应Ⅰ的化学反应方程式:_____________________。
②若已知U、V均为氧化物:则
a.中国北京曙光公司研制出了第一款具有我国完全自主:
知识产权的高性能CPU芯片——“龙芯”Ⅰ号。“龙芯”(芯片)的主要化学成分是Y,该材料的化学式是:________ ;
b.计算机长距离联网使用的传输速度快、信息量大的线路,使用的材料的主要化学成分是U,该材料的名称是:________;
c.这种材料埋在地下时,如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因__________。
(2)如果X、Y的组成元素不同主族时,若Z是通常情况下密度最小的物质,则反应Ⅰ的化学反应方程式:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com