
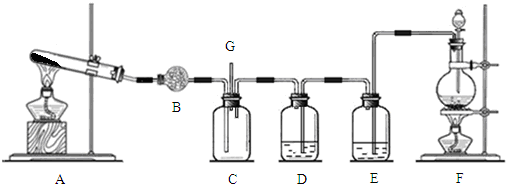
分析 (1)实验室用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成氯化锰、氯气与水;
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,先用饱和食盐水除去HCl,再用浓硫酸除去水蒸气;
(3)装置A是用固体氯化铵和固体氢氧化钙加热制备氨气,用该装置还可以制备氧气;
(4)计算氯化铵的物质的量,根据N原子守恒计算氨气物质的量,再根据V=nVm计算氨气体积;
(5)装置C中有白烟产生,是由于氨气与HCl反应生成氯化铵;
(6)氯气能与氢氧化钠溶液反应,用氢氧化钠溶液吸收过量的氯气,防止污染空气.
解答 解:(1)实验室用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,E中盛放饱和食盐水,除去HCl,D中盛放浓硫酸,除去水蒸气,干燥氯气,
故答案为:浓硫酸;干燥氯气;
(3)装置A是用固体氯化铵和固体氢氧化钙加热制备氨气,还可以加热高锰酸钾或加热氯酸钾与二氧化锰混合物制备氧气,
故答案为:O2;
(4)氯化铵的物质的量为$\frac{10.7g}{53.5g/mol}$=0.2mol,根据N原子守恒,可知生成氨气物质的量为0.2mol,标况下制得氨气体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(5)装置C中有白烟产生,是由于氨气与HCl反应生成氯化铵,反应方程式为:NH3+HCl=NH4Cl,
故答案为:NH3+HCl=NH4Cl;
(6)氯气能与氢氧化钠溶液发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,可以用盛有氢氧化钠溶液的洗气瓶吸收,防止污染空气,
故答案为:NaOH溶液.
点评 本题考查氯气、氨气的制备和性质实验,题目难度不大,注意把握实验的原理和物质的化学性质,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 在NaHCO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | |
| B. | 在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在Na2CO3和NaHCO3两溶液中,离子种类不相同 | |
| D. | 在NaHCO3溶液中一定有c(Na+)>c(CO32-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金属可作为牺牲阳极保护法的阳极,保护Y金属 | |
| B. | Y金属不能从硫酸溶液中置换出氢气 | |
| C. | 三种金属的活泼性顺序为:Y>X>Z | |
| D. | Z和Y能构成电压最大的原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当v(H2)=v(H2O)时,达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})•{c}^{4}({H}_{2}O)}{c(S{O}_{2})•{c}^{2}(NO)•{c}^{4}({H}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热胆矾失去结晶水的过程称风化 | |
| B. | 在饱和溶液中,溶质溶解的速率等于结晶速率 | |
| C. | 原电池是把电能转化为化学能的装置 | |
| D. | 电能是二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.
某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构 | |
| D. | 蔗糖是还原性糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com