��2013?̩��һģ������ͭ��һ��Ӧ�ù㷺�Ļ���ԭ�ϣ�ʵ�����п�ͨ����ͬ;����ȡ����ͭ��Һ�͵�����CuSO
4?5H
2O��������һ���������£�
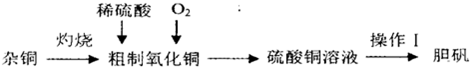
��1������I����Ϊ
����Ũ��
����Ũ��
��
��ȴ�ᾧ
��ȴ�ᾧ
�����ˡ���ɣ�
��2����ͭ���������л�����պ�IJ��������ͭ��������ͭ��ԭ�������
ab
ab
������ĸ���ţ���
a�����չ����в�������ͭ����ԭ
b�����ղ���֣�ͭδ����ȫ����
c������ͭ�ڼ��ȹ����зֽ�����ͭ
d����������ͭ������������
��3��������ͭ��Ϊ������ͭ�ۣ���ֱ�������м���ϡ�����Fe
2��SO
4��
3��Һ������ͨ����������Ӧ��ȫ�������м������
Cu
Cu
���ѧʽ����ͬ��������pH��4������
Fe��OH��3
Fe��OH��3
���������˵�����ͭ��Һ[��֪Fe��OH��
3��Cu��OH��
2��ȫ����ʱ��pH�ֱ�Ϊ3.7��6.4]��
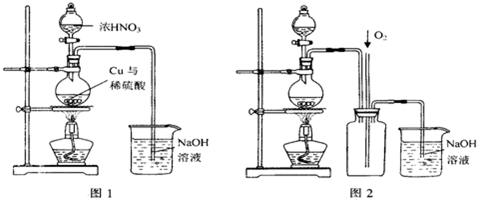
��4��ͨ������ͼ1װ��Ҳ����ȡ����ͭ��Һ����֪��2NaOH+2NO
2=NaNO
3+NaNO
2+H
2O����
��ƿ�ڷ�����Ӧ�����ӷ���ʽΪ
Cu+4H++2NO3-=Cu2++2NO2��+2H2O��3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O
Cu+4H++2NO3-=Cu2++2NO2��+2H2O��3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O
��
ͼ2��ͼ1�ĸĽ�װ�ã����ŵ��Т�
��ֹ����������Һ�������뷢��װ��
��ֹ����������Һ�������뷢��װ��
����
һ�����������������ж������ܱ���ȫ����
һ�����������������ж������ܱ���ȫ����
��

 ��2013?̩��һģ����ѡ���еĵ缫����Һ����ͼ��ʾװ�ÿ����ԭ��أ�������������������ȷ���ǣ�������
��2013?̩��һģ����ѡ���еĵ缫����Һ����ͼ��ʾװ�ÿ����ԭ��أ�������������������ȷ���ǣ�������


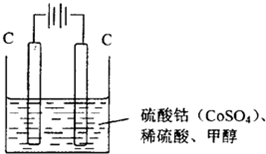 ��2013?̩��һģ���о�̼���仯��������ʶԴٽ���̼���Ĺ���������Ҫ���壮
��2013?̩��һģ���о�̼���仯��������ʶԴٽ���̼���Ĺ���������Ҫ���壮

