
| Y | V | |||
| X | W |
| A. | 原子半径:X>W>V>Y | |
| B. | Y的最高价氧化物的电子式为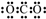 | |
| C. | X的最高价氧化物能与V、W最高价氧化物对应的水化物反应 | |
| D. | 甲、乙混合时所生成的白烟为离子化合物,只含有离子键 |
分析 V、W、X、Y均是元素周期表中短周期元素,由元素位置可知,Y、V处于第二周期,X、W处于第三周期;V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成,则甲、乙为NH3、HCl,结合V、W在周期表中的位置可知甲为NH3、乙为HCl,V为N元素、W为Cl;则Y为C、X为Al元素,据此进行解答.
解答 解:V、W、X、Y均是元素周期表中短周期元素,由元素位置可知,Y、V处于第二周期,X、W处于第三周期;V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成,则甲、乙为NH3、HCl,结合V、W在周期表中的位置可知甲为NH3、乙为HCl,V为N元素、W为Cl;则Y为C、X为Al元素,
A.电子层越多,原子半径越大,同一周期中原子序数越大,原子半径越小,则原子半径大小为:X>W>Y>V,故A错误;
B.Y为C元素,其最高价氧化物为二氧化碳,二氧化碳为共价化合物,其电子式为: ,故B错误;
,故B错误;
C.X的最高价氧化物为氧化铝,V、W最高价氧化物对应的水化物分别为硝酸和高氯酸,氧化铝能够与硝酸和高氯酸反应,故C正确;
D.甲为NH3、乙为HCl,二者反应生成氯化铵,氯化铵为离子化合物,氯化铵中含有离子键和共价键,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,“甲、乙混合时有白烟生成”为突破口,注意掌握原子结构与元素周期律、元素周期表的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
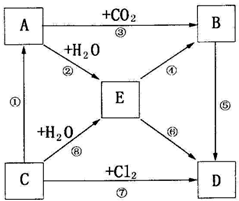
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳浊液 | B. | 溶液 | C. | 胶体 | D. | 悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
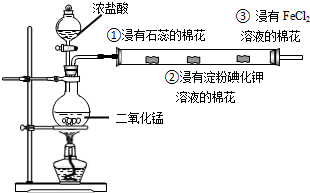
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 43.2 g | B. | 46.8 g | C. | 53.6 g | D. | 63.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
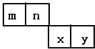 m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则: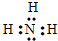 ,空间构型为三角锥形.
,空间构型为三角锥形.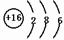 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com