
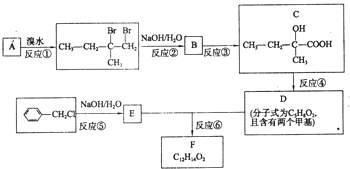
 分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.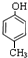 .
. 分析 A和溴水发生的是加成反应,根据加成产物可判断A的结构简式为CH2=C(CH3)CH2CH3,反应②是水解反应,生成物B的结构简式为CH3CH2C(CH3)OHCH2OH.B氧化得到C,则C的结构简式为CH3CH2C(CH3)OHCOOH.根据C和D的分子式的可判断,反应④是消去反应,又D含两个甲基,所以D的结构简式为CH3CH=C(CH3)COOH,反应⑤属于卤代烃的水解反应,则E的结构简式为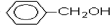 ,反应⑥为E和D通过酯化反应生成F,则F的结构简式为
,反应⑥为E和D通过酯化反应生成F,则F的结构简式为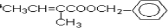 ,以此解答该题.
,以此解答该题.
解答 解:(1)由以上分析可知D为CH3CH=C(CH3)COOH,含有碳碳双键和羧基,故答案为:碳碳双键、羧基;
(2)B的结构简式为CH3CH2C(CH3)OHCH2OH.B氧化得到C,故答案为:氧化反应;
(3)反应④为CH3CH2C(CH3)OHCOOH在浓硫酸作用下发生消去反应,反应的方程式为CH3CH2C(CH3)OHCOOH$→_{△}^{浓硫酸}$CH3CH=C(CH3)COOH+H2O,故答案为:CH3CH2C(CH3)OHCOOH$→_{△}^{浓硫酸}$CH3CH=C(CH3)COOH+H2O;
(4) 的同分异构体的结符合条件:①属于芳香族化合物,②遇浓溴水能产生白色沉淀,含有酚羟基,③苯环上的取代物只有两种,含有2个取代基且处于对位,同分异构体的结构简式为:
的同分异构体的结符合条件:①属于芳香族化合物,②遇浓溴水能产生白色沉淀,含有酚羟基,③苯环上的取代物只有两种,含有2个取代基且处于对位,同分异构体的结构简式为: ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,为高考常见题型,侧重于学生的分析能力的考查,题目难度中等,注意充分利用分子式进行推断采取正、逆相结合进行推断,把握官能团的性质以及官能团的转化为解答该题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三组中Na2O2均作氧化剂 | |
| B. | 第②组反应中生成1molO2,转移电子的物质的量为4mol | |
| C. | 第③组反应中产物还有Na2SO4 | |
| D. | 氧化性的强弱顺序为Na2O2>MnO4->FeO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
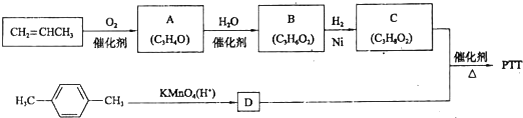
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | CO与N2互为等电子体,标准状况下11.2 L CO与0.5 molN2所含电子数相等 | |
| D. | 将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠水溶液具有强氧化性,故可用作消毒剂 | |
| B. | 氢氟酸能蚀刻玻璃,是利用氢氟酸的弱酸性 | |
| C. | 常温下,铝能被浓硫酸钝化,可用铝罐贮运浓硫酸 | |
| D. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O溶液的c(OH-)>NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液分别与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将pH值相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
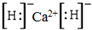 ;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.
;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com