
分析 分析反应中元素化合价变化,所含元素化合价升高的反应物为还原剂,对应产物为氧化产物,所含元素化合价降低的反应物为氧化剂,对应产物为还原产物,锌与硝酸的反应中,锌化合价从0价升高为+2价的锌离子,硝酸根离子中+5价的氮元素化合价降为+1价的氮,依据得失电子守恒配平方程式,用单线桥表示,计算转移3mol电子消耗锌的质量.
解答 解:(1)锌与硝酸的反应中,锌化合价从0价升高为+2价的锌离子,硝酸根离子中+5价的氮元素化合价降为+1价的氮,要使氧化剂得到电子数等于还原剂失去电子数,则锌的系数为4,N2O系数为1,依据原子个数守恒可知反应的方程式:4Zn+10HNO3═1N2O↑+4Zn(NO3)2+5H2O;
故答案为:4;10;1;4;5;
(2)4Zn+10HNO3═1N2O↑+4Zn(NO3)2+5H2O反应中锌化合价从0价升高为+2价的锌离子,硝酸根离子中+5价的氮元素化合价降为+1价的氮,4mol锌参加反应失去8mol电子,用单线桥表示为: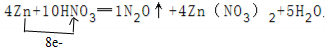 ;
;
故答案为: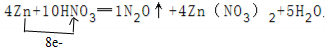 ;
;
(3)反应中锌化合价升高为还原剂,对应产物硝酸锌为氧化产物,硝酸中氮化合价降低为氧化剂,对应产物N2O为还原产物,
故答案为:HNO3;Zn(NO3)2;
(4)依据、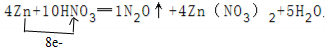 可知转移8mol电子消耗4mol锌,则转移3mol电子消耗锌的物质的量为1.5mol,质量为1.5mol×65g/mol=97.5g;
可知转移8mol电子消耗4mol锌,则转移3mol电子消耗锌的物质的量为1.5mol,质量为1.5mol×65g/mol=97.5g;
故答案为:97.5g.
点评 本题考查了氧化还原方程式的配平、双线桥表示、氧化还原反应基本概念及计算,明确氧化还原反应基本概念及得失电子守恒规律是解题关键,题目难度中等.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:解答题
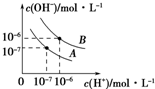 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 分子数 | C. | 质量 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2NH4HCO3$\stackrel{△}{→}$2NH3↑+H2O+CO2↑ | ||
| C. | 4HCl+O2$\stackrel{△}{→}$2H2O+2Cl2 | D. | NaHCO3+NaHSO4═Na2SO4+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
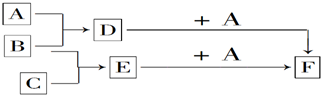
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
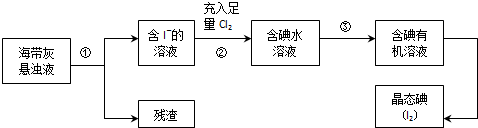
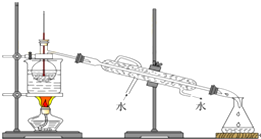
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com