
(16分)
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和比OH―多0.05mol。
科目:高中化学 来源: 题型:
 Ⅰ.如图所示为常见仪器的部分结构.
Ⅰ.如图所示为常见仪器的部分结构.查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化钠溶液 分子式:NaOH 相对分子质量:40 密度:1.2g?cm-3 质量分数:20%(1)该NaOH溶液的物质的量浓度为 6 6 mol/L.(2)现在要配制该浓度的NaOH溶液100ml,需称量 24.0 24.0 g固体氢氧化钠.溶液配制的所需的基本步骤如下: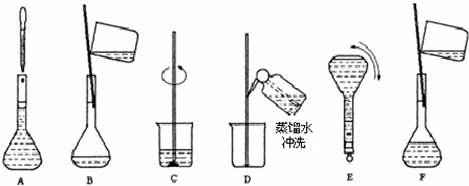 (3)将上述实验步骤A到F按实验过程先后次序排列 CBDFAE CBDFAE .(4)上述实验步骤A、B、E、F都用到的仪器名称为 100ml容量瓶 100ml容量瓶 .(5)下列操作对NaOH溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”). ①摇匀后发现液面低于刻度线再加水 偏低 偏低 ;②容量瓶中原有少量蒸馏水 无影响 无影响 ;③定容时俯视观察液面 偏高 偏高 .
查看答案和解析>> 科目:高中化学 来源: 题型: 熟悉化学实验仪器的用途和用法,能正确进行实验操作是做好化学实验的前提.下面给出了一些实验的装置或操作图,请按要求回答有关问题. (1)如图1所示是某些气体的制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是 B B (填序号,下同).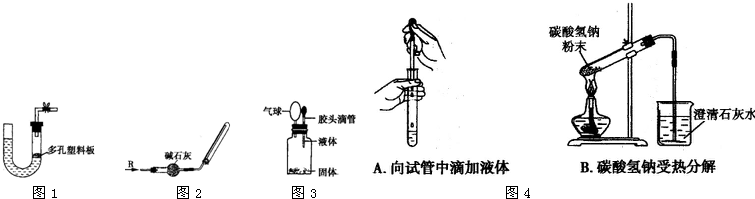 A.用大理石和稀硫酸制取二氧化碳 B.用锌粒和稀硫酸制氢气 C.用浓硫酸和亚硫酸钠制取二氧化硫 D.用高锰酸钾固体和浓盐酸制取氯气 (2)实验室可用如图2所示装置干燥并收集某气体R,则R可能是 B B .A.SO2 B.NH3 C.NO D.Cl2 (3)某同学用如图3所示装置进行实验,实验过程中出现小气球鼓起来的现象,则使用的固体和液体试剂可能是 C C .A.铜与浓硫酸 B.铁与浓硫酸 C.铝和氢氧化钠溶液 D.二氧化锰和浓盐酸 (4)指出图4两个实验中各存在的一个错误. ① 胶头滴管伸入试管内部 胶头滴管伸入试管内部 ,② 试管口向上倾斜 试管口向上倾斜 .查看答案和解析>> 科目:高中化学 来源:吉林省油田高中2010-2011学年高一下学期期中考试化学理科试题 题型:058 有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置一起已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞b和c,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象.试回答下列问题:
(1)C中热水的作用:________. (2)M处发生的反应的化学方程式为:________. (3)从M中可观察到的现象:________从中可认识到该实验过程中催化剂________(填“参加”或“不参加”)化学反应,还可以认识到该反应的催化作用需要一定的________. (4)实验一段时间后,如果撤掉酒精灯,反应还能继续进行,其原因是________. 查看答案和解析>> 科目:高中化学 来源:浙江省模拟题 题型:推断题 近年来,许多专家对石灰氮重新进行了深入研究,这也使得石灰氮这一古老的肥料又焕发了新的活力。石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、氮的质量分数分别为50%、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平)。 请回答下列问题: (1)石灰氮的化学式为__________________。 (2)写出足量B和C与氯化钠溶液反应的化学方程式:__________________。 (3)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,含氮产物为__________(填化学式)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_________ (填序号)。 a. 磷酸 b. 二氧化碳 c. 稀硫酸 d. 二氧化硫 e. 次氯酸 (4)工业废水中的NO2-可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质。写出上述反应的离子方程式:_______________。若改用电解法将废水中NO2- 转换为N2除去,N2将在_________(填电极名称)生成。 (5)某研究小组学生提出检验火柴头上KClO3实验方案如下 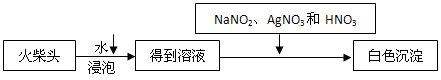 有关的离子反应方程式为_______________。 (6)在(5)方案基础上,要确定火柴头中含KClO3,还需进行的实验操作为_________。 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |