
����Ŀ��Ѫ�����к���C��O��N��Fe����Ԫ�أ��ش��������⣺
��1��C��N��O����Ԫ���е縺����С���� �� ����Ԫ�ط��ţ���д����̬Feԭ�ӵĺ�������Ų�ʽ����д�� ��
��2����ͼ1��ʾΪѪ�쵰�ͼ��쵰�Ļ��Բ��֩���Ѫ���صĽṹʽ��Ѫ������Nԭ�ӵ��ӻ���ʽ�� �� ����ͼ2�ķ������á��������Fe2+����λ���� 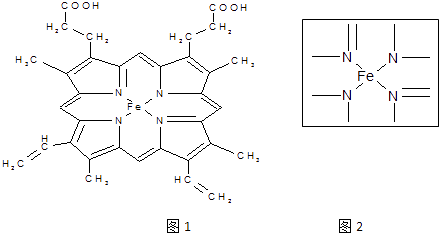
��3��NiO��FeO�ľ���ṹ���;����Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm�����۵�NiOFeO ���������������
��4�����ݵȵ���ԭ����д��CN���ĵ���ʽ �� 1mol O22+�к��еĦм���ĿΪ ��
��5�����Цġ��á�������ͬ�������壬�þ��徧���������е���ԭ����Ϊ �� �ġ������־�������ԭ�ӵ���λ��֮��Ϊ �� 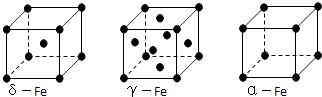
��6������������ɽ�ΪTiCl3.6H2O�ľ��壬���� Ti3+����λ����Ϊ6����һ��Ϊ��ɫ��
��һ��Ϊ��ɫ��Ϊ�ⶨ�����־���Ļ�ѧʽ������ʵ�飺
����������ᄃ���ȡ1mol��ɴ�����Һ��
�ڷֱ���������Һ�е���AgNO3��Һ����������ɫ������
�۳�����ȫ��ֱ���ˡ�ϴ�ӡ���������������ԭ��ɫ�����ˮ��Һ��AgNO3��Һ��Ӧ�õ��İ�ɫ����Ϊ3mol����ɫ�����ˮ��Һ��Ӧ�õ��İ�ɫ����Ϊ2mol������ɫ����Ļ�ѧʽΪ ��
���𰸡�
��1��C��[Ar]3d64S2
��2��sp2��sp3
��3����
��4��![]() ��2NA
��2NA
��5��4��4��3
��6��[TiCl��H2O��5]Cl2?H2O
���������⣺��1.��ͬ����Ԫ�ش�����Ԫ�صĵ縺�����������е縺��C��N��O��C�ĵ縺����С����̬Feԭ�ӵĺ���۵����Ų�ʽΪ��[Ar]3d64S2 �� �ʴ��ǣ�C��[Ar]3d64S2��
��2.������Nԭ�ӵļ۵����Ų�ʽ2s22p3 �� ��Nԭ���γ�3�����ۼ�����ԭ����Χ����һ�Թ¶Ե��ӣ�����ʱ����λ�����õ�ԭ��Ϊsp3�ӻ�����NH3 �� ��Nԭ���γ�4�����ۼ��������һ������λ������������˫����˫����Ϊ����������õ�ԭ��Ϊsp2�ӻ����籾���е�  ������Ϊ��������õ�ԭ��Ϊsp3�ӻ�����NH4+ �� ���Դ��ǣ�sp2��sp3��
������Ϊ��������õ�ԭ��Ϊsp3�ӻ�����NH4+ �� ���Դ��ǣ�sp2��sp3��  ��
��
��3.��Ni0��Fe0�ľ���ṹ���;����Ȼ��Ƶ���ͬ��˵�����߶������Ӿ��壬���Ӿ�����۵������Ӽ���ǿ���йأ��������������Խ�࣬���Ӱ뾶ԽС�����Ӽ�Խǿ���۵�Խ�ߣ�����Ni2+�����Ӱ뾶С��Fe2+�����Ӱ뾶�������۵���NiO��FeO�����Դ��ǣ�����
��4.��N2��CN��Ϊ�ȵ����壬������������ͨ�����õ��Ӷ��γɹ��ۼ�����ԭ�Ӻ�����5�����ӣ��γɵ��������������ӵĵ���ʽΪ ![]() �����ݵ������ӵĵ���ʽд��CN���ĵ���ʽ����CN�������ӣ����������ʽΪ��
�����ݵ������ӵĵ���ʽд��CN���ĵ���ʽ����CN�������ӣ����������ʽΪ�� ![]() �����ݵȵ�����ԭ����֪��O22+�ĵ���ʽ
�����ݵȵ�����ԭ����֪��O22+�ĵ���ʽ ![]() ����1mol��������2mol�Ħм���1mol�Ħļ�����1mol O22+�У�����2NA���м����ʴ��ǣ�
����1mol��������2mol�Ħм���1mol�Ħļ�����1mol O22+�У�����2NA���м����ʴ��ǣ� ![]() ��2NA��
��2NA��
��5.���þ��徧���������е���ԭ����Ϊ8�� ![]() +6��
+6�� ![]() =4���ġ������־�������ԭ�ӵ���λ���ֱ�Ϊ8��6������λ��֮��Ϊ8��6=4��3�����Դ��ǣ�4�� 4��3��
=4���ġ������־�������ԭ�ӵ���λ���ֱ�Ϊ8��6������λ��֮��Ϊ8��6=4��3�����Դ��ǣ�4�� 4��3��
��6.�������ӿ����������ӷ�Ӧ�����Ȼ�����ɫ������ͨ�����������������ƶϳ������ӵĺ���������ԭ��ɫ�����ˮ��Һ��AgNO3��Һ��Ӧ�õ��İ�ɫ����Ϊ3mol����ɫ�����ˮ��Һ��Ӧ�õ��İ�ɫ����Ϊ2mol�����־������ɽ�ΪTiCl36H2O��˵����ɫ�����������������ƶ��������ӣ�����ɫ������ֻ��2�������ƶ������ӣ�����һ����ԭ���γ���������Ϊ��Ϊ6��λ������������������ˮ������ѧʽΪ[TiCl��H2O��5]Cl2H2O������ɫ����Ļ�ѧʽΪ[Ti��H2O��6]Cl3 �� ���Դ��ǣ�[TiCl��H2O��5]Cl2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��E��F���ֳ������ʺ���ͬһԪ��M����һ����������������ͼת����ϵ��Z��NO�������ƶϲ��������ǣ� �� 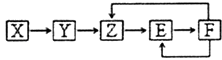
A.X������һ���⻯��
B.X����Zһ���ǻ��Ϸ�Ӧ
C.E������һ����ɫ����
D.F��MԪ�صĻ��ϼۿ���Ϊ+5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��ԭ�Ӱ뾶����Դ�С��������ۻ��������ԭ�������ı仯��ϵ��ͼ��ʾ������˵����ȷ����

A. ���Ӱ뾶�Ĵ�С˳��d<e<f
B. ��x�γɼ�����ķе㣺y>z>d
C. ��ȥʵ����Թ��в�����g���ʣ������ȵ�����������Һ
D. g��h���������Ӧ��ˮ��������ԣ�h>g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ������ش��������⣺
��1��д��ԭ��������С�ĵڢ���Ԫ��ԭ�ӵ�ԭ�ӽṹʾ��ͼ ��
��2��д��3p�������2��δ�ɶԵ��ӵ�Ԫ�صķ��ţ� ��
��3����Ԫ�ر���ѧ�ҳ�֮Ϊ������Ԫ���еġ�����֮��������ԭ�ӵ���Χ�����Ų�ʽΪ4s24p4 �� ��Ԫ�ص������� ��
��4����֪���л�ѧ���ļ��ܣ�Si��O��460kJ/mol��Si��Si��175kJ/mol��O=O��498kJ/mol����Ӧ��Si+O2=SiO2�ķ�Ӧ�ȡ�H= ��
��5��д�����������ˮ����������Sԭ�ӣ�Oԭ�ӷֱ�������ӻ���ʽ����ռ乹�ͷֱ�Ϊ�� ��
��6���������ʾ����ʾHFˮ��Һ�е�������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�ȥ���ʵķ�����ȷ���ǣ� ��
A. ��ȥCO2�е�����HCl��ͨ��NaOH��Һ
B. ��ȥNaCl��Һ�е�����MgCl2����������KOH��Һ������
C. ��ȥKCl��Һ�е�����K2CO3����������������
D. ��ȥN2�е�����O2��ͨ�����ȵ�CuO��ĩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊԭ���Ʊ�1��2���������飬���з����к������ǣ� ��
A.CH3CH2Cl ![]() CH3CH2OH
CH3CH2OH ![]() CH2=CH2
CH2=CH2 ![]() CH2BrCH2Br
CH2BrCH2Br
B.CH3CH2Cl ![]() CH2BrCH2Br
CH2BrCH2Br
C.CH3CH2Cl ![]() CH2=CH2
CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH2BrCH2Br
CH2BrCH2Br
D.CH3CH2Cl ![]() CH2=CH2
CH2=CH2 ![]() CH2BrCH2Br
CH2BrCH2Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Cl��Һ��pH��ϡHCl��pH��Ϊ5��������ˮ�������c��H+���ֱ�Ϊx molL��1��y molL��1 �� ��x��y�ı�ֵ��ȷ���ǣ�������
A.1
B.10
C.104
D.10��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ࡢ��֬����������������Ҫ����Դ���ʣ���������ǵ����ʻش��������⣺
��1����֬�����Ժͼ���������ˮ��Ĺ�ͬ��������д���ƣ���
��2�������ʵ�ˮ�������еĹ���������д�ṹ��ʽ����
��3����֪A��������������һ����Ȼ�߷��ӻ����B��C�ֱ���A�ڲ�ͬ�����µ�ˮ��������������ת����ϵ��
������˵������ȷ���ǣ�
A��1molC��ȫˮ�������2molB
B����ҵ�ϳ����÷�Ӧ�߸���ˮƿ������
C����A������ƵĹ��̾���A��ˮ�ⷴӦ����
D��A��ˮ��Һ���Է��������ЧӦ
E����Ӧ���������ȷ�Ӧ
�������ʵ��֤��Aͨ����Ӧ���Ѿ�ȫ��ˮ�⣬д����������������ͽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.��ϵͳ�������������� ![]() ������ʽ�ṹ����������2��3��5��5���ļ���4��4�����һ�����
������ʽ�ṹ����������2��3��5��5���ļ���4��4�����һ�����
B.����ϩ�뻯����  ������ʽ�ṹ����Ϊͬϵ��
������ʽ�ṹ����Ϊͬϵ��
C.����ʽΪC4H8O2���л��������������¿�ˮ��Ϊ��ʹ����������п��ܵõ��Ĵ������������������γɵ�������16��
D.�����ʵ����ı��ͱ�������ȫȼ�����������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com