
”¾ĢāÄæ”放2014ŠĀæĪ±ź2”æŌŚČŻ»żĪŖ1.00LµÄČŻĘ÷ÖŠ£¬ĶØČėŅ»¶ØĮæµÄN2O4£¬·¢Éś·“Ó¦N2O4(g)![]() 2NO2(g)£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī”£
2NO2(g)£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
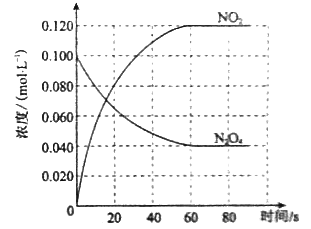
£Ø1£©·“Ó¦µÄ”÷H 0£ØĢī”°“óÓŚ”±»ņ”°Š”ÓŚ”±£©£»100”ꏱ£¬ĢåĻµÖŠø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆČēÉĻĶ¼ĖłŹ¾”£ŌŚ0~60sŹ±¶Ī£¬·“Ó¦ĖŁĀŹv(N2O4)ĪŖ molL-1s-1£»·“Ó¦µÄĘ½ŗā³£ŹżK1ĪŖ ”£
£Ø2£©100”ꏱ“ļµ½Ę½ŗāŗó£¬øı䷓ӦĪĀ¶ČĪŖT£¬c(N2O4)ŅŌ0.0020 molL-1s-1µÄĘ½¾łĖŁĀŹ½µµĶ£¬¾10sÓÖ“ļµ½Ę½ŗā”£
a£ŗT 100”ę£ØĢī”°“óÓŚ”±»ņ”°Š”ÓŚ”±£©£¬ÅŠ¶ĻĄķÓÉŹĒ ”£
b£ŗĮŠŹ½¼ĘĖćĪĀ¶ČTŹ±·“Ó¦µÄĘ½ŗā³£ŹżK2 ”£
£Ø3£©ĪĀ¶ČTŹ±·“Ó¦“ļĘ½ŗāŗ󣬽«·“ӦȯĘ÷µÄČŻ»ż¼õÉŁŅ»°ė£¬Ę½ŗāĻņ £ØĢī”°Õż·“Ó¦”±»ņ”°Äę·“Ó¦”±£©·½ĻņŅĘ¶Æ£¬ÅŠ¶ĻĄķÓÉŹĒ ”£
”¾“š°ø”æ
£Ø1£©“óÓŚ 0.001 0.36 mol”¤L”Ŗ1”£
£Ø2£©a£ŗ“óÓŚ£»
·“Ó¦Õż·½ĻņĪüČČ£¬·“Ó¦ĻņĪüČČ·½Ļņ½ųŠŠ£¬¹ŹĪĀ¶ČÉżøß
b£ŗĘ½ŗāŹ±£¬c£ØNO2£©=0.120 mol”¤L”Ŗ1+0.002 mol”¤L”Ŗ1”¤s”Ŗ1”Į10s”Į2=0.160mol”¤L”Ŗ1
c£ØN2O4£©=0.040 mol”¤L”Ŗ1”Ŗ0.002 mol”¤L”Ŗ1”¤s”Ŗ1”Į10s=0.02 mol”¤L”Ŗ1
K2= £Ø0.160mol”¤L”Ŗ1£©2/0.020mol”¤L”Ŗ1=1.3mol”¤L”Ŗ1
£Ø3£©Äę·“Ó¦ ¶ŌĘųĢå·Ö×ÓŹżŌö“óµÄ·“Ó¦£¬Ōö“óŃ¹ĒæĘ½ŗāĻņÄę·“Ó¦·½ĻņŅʶÆ
”¾½āĪö”æ±¾ĢāµÄ½āĢāŅŖµćĪŖ£ŗŹģĻ¤»Æѧ·“Ó¦ĖŁĀŹ”¢»ÆŃ§Ę½ŗā³£ŹżµÄøÅÄī¼°Ļą¹Ų¼ĘĖć¹«Ź½£¬ÕĘĪÕĶā½ēĢõ¼ž¶Ō»Æѧ·“Ó¦ĖŁĀŹŗĶ»ÆŃ§Ę½ŗāµÄÓ°Ļģ¹ęĀÉ”£×öĢāŹ±Ņ»¶ØŅŖČĻÕęÉóĢā£¬æ“ĒåĢāøÉĢį¹©µÄĪÄ×ÖŠÅĻ¢ŗĶŹż¾Ż£¬×¼Č··ÖĪöĢāøųĶ¼ĻńµÄĻą¹ŲŠÅĻ¢£¬×„×””°c(N2O4)ŅŌ0.0020 molL-1s-1µÄĘ½¾łĖŁĀŹ½µµĶ”±µČ¹Ų¼ü×ÖŃŪ£¬×¼Č·½ųŠŠĻą¹ŲµÄŹżŃ§¼ĘĖć”£
£Ø1£©øł¾ŻĢāŅā½įŗĻ·“Ó¦N2O4(g)![]() 2NO2(g)ÖŖ£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī£¬Ōņ¶žŃõ»ÆµŖµÄÅضČŌö“ó£¬ĖµĆ÷Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£»øł¾ŻĪĀ¶Č¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ¹ęĀÉ£ŗ”°µ±ĘäĖūĢõ¼ž²»±äŹ±£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ”±ÖŖ£¬øĆ·“Ó¦Õż·“Ó¦·½ĻņĪŖĪüČČ·“Ó¦£¬”÷H“óÓŚ0”£øł¾ŻĢāøųĶ¼ĻńÖŖ£¬0”Ŗ”Ŗ60sŹ±¶Ī£¬N2O4µÄĪļÖŹµÄĮæÅضČÓÉ0.100 mol”¤L”Ŗ1½µµĶĪŖ0.040 mol”¤L”Ŗ1£¬ĪļÖŹµÄĮæÅØ¶Č±ä»ÆĪŖ0.060 mol”¤L”Ŗ1£¬øł¾Ż¹«Ź½v=”÷c/”÷t¼ĘĖć£¬v (N2O4)= 0.060 mol”¤L”Ŗ1/60s=0.001 mol”¤L”Ŗ1”¤s”Ŗ1£»·ÖĪöĢāøųĶ¼ĻńÖŖ£¬¶žŃõ»ÆµŖµÄĘ½ŗāÅضČĪŖ0.120 mol”¤L”Ŗ1£¬ĖÄŃõ»Æ¶žµŖµÄĘ½ŗāÅضČĪŖ0.040 mol”¤L”Ŗ1£¬½įŗĻ·“Ó¦N2O4(g)
2NO2(g)ÖŖ£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī£¬Ōņ¶žŃõ»ÆµŖµÄÅضČŌö“ó£¬ĖµĆ÷Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£»øł¾ŻĪĀ¶Č¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ¹ęĀÉ£ŗ”°µ±ĘäĖūĢõ¼ž²»±äŹ±£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ”±ÖŖ£¬øĆ·“Ó¦Õż·“Ó¦·½ĻņĪŖĪüČČ·“Ó¦£¬”÷H“óÓŚ0”£øł¾ŻĢāøųĶ¼ĻńÖŖ£¬0”Ŗ”Ŗ60sŹ±¶Ī£¬N2O4µÄĪļÖŹµÄĮæÅضČÓÉ0.100 mol”¤L”Ŗ1½µµĶĪŖ0.040 mol”¤L”Ŗ1£¬ĪļÖŹµÄĮæÅØ¶Č±ä»ÆĪŖ0.060 mol”¤L”Ŗ1£¬øł¾Ż¹«Ź½v=”÷c/”÷t¼ĘĖć£¬v (N2O4)= 0.060 mol”¤L”Ŗ1/60s=0.001 mol”¤L”Ŗ1”¤s”Ŗ1£»·ÖĪöĢāøųĶ¼ĻńÖŖ£¬¶žŃõ»ÆµŖµÄĘ½ŗāÅضČĪŖ0.120 mol”¤L”Ŗ1£¬ĖÄŃõ»Æ¶žµŖµÄĘ½ŗāÅضČĪŖ0.040 mol”¤L”Ŗ1£¬½įŗĻ·“Ó¦N2O4(g)![]() 2NO2(g)ÖŖ£¬K1= [NO2 ]2/[N2O4]= £Ø0.120mol”¤L”Ŗ1£©2/0.040mol”¤L”Ŗ1=0.36 mol”¤L”Ŗ1”£
2NO2(g)ÖŖ£¬K1= [NO2 ]2/[N2O4]= £Ø0.120mol”¤L”Ŗ1£©2/0.040mol”¤L”Ŗ1=0.36 mol”¤L”Ŗ1”£
£Ø2£©a£ŗøł¾ŻĢāŅāÖŖ£¬øı䷓ӦĪĀ¶ČĪŖTŗó£¬c(N2O4)ŅŌ0.0020 molL-1s-1µÄĘ½¾łĖŁĀŹ½µµĶ£¬¼“·“Ó¦N2O4(g)![]() 2NO2(g)Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ÓÖøĆ·“Ó¦Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬¹ŹøıäµÄĢõ¼žĪŖÉżøßĪĀ¶Č£¬T“óÓŚ1000C£¬“š°øĪŖ£ŗ“óÓŚ£»·“Ó¦Õż·½ĻņĪüČČ£¬·“Ó¦ĻņĪüČČ·½Ļņ½ųŠŠ£¬¹ŹĪĀ¶ČÉżøߣ»
2NO2(g)Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ÓÖøĆ·“Ó¦Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬¹ŹøıäµÄĢõ¼žĪŖÉżøßĪĀ¶Č£¬T“óÓŚ1000C£¬“š°øĪŖ£ŗ“óÓŚ£»·“Ó¦Õż·½ĻņĪüČČ£¬·“Ó¦ĻņĪüČČ·½Ļņ½ųŠŠ£¬¹ŹĪĀ¶ČÉżøߣ»
b£ŗøł¾ŻĢāŅāÖŖ£¬Ę½ŗāŹ±£¬c£ØNO2£©=0.120 mol”¤L”Ŗ1+0.002 mol”¤L”Ŗ1”¤s”Ŗ1”Į10s”Į2=0.160mol”¤L”Ŗ1£¬
c£ØN2O4£©=0.040 mol”¤L”Ŗ1”Ŗ0.002 mol”¤L”Ŗ1”¤s”Ŗ1”Į10s=0.02 mol”¤L”Ŗ1£¬
K2= [NO2 ]2/[N2O4]= £Ø0.160mol”¤L”Ŗ1£©2/0.020mol”¤L”Ŗ1=1.3mol”¤L”Ŗ1”£
£Ø3£©øł¾ŻĢāŅāÖŖ£¬·“Ó¦“ļĘ½ŗāŗ󣬽«·“ӦȯĘ÷µÄĢå»ż¼õŠ”Ņ»°ė£¬¼“Ōö“óŃ¹Ē棬øł¾ŻŃ¹Ēæ¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ¹ęĀÉ£ŗ”°µ±ĘäĖūĢõ¼ž²»±äŹ±£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāĻņĘųĢåĪļÖŹĻµŹż¼õŠ”µÄ·½ĻņŅĘ¶Æ”±ÖŖ£¬·“Ó¦N2O4(g)![]() 2NO2(g)µÄĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬“š°øĪŖ£ŗÄę·“Ó¦ ¶ŌĘųĢå·Ö×ÓŹżŌö“óµÄ·“Ó¦£¬Ōö“óŃ¹ĒæĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ”£
2NO2(g)µÄĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬“š°øĪŖ£ŗÄę·“Ó¦ ¶ŌĘųĢå·Ö×ÓŹżŌö“óµÄ·“Ó¦£¬Ōö“óŃ¹ĒæĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·“Ó¦C(s)+H2O(g) ![]() CO(g)+H2(g)ŌŚŅ»æɱäČŻ»żµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ĻĀĮŠĢõ¼žµÄøıä¶ŌĘä·“Ó¦ĖŁĀŹ¼øŗõĪŽÓ°ĻģµÄŹĒ
CO(g)+H2(g)ŌŚŅ»æɱäČŻ»żµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ĻĀĮŠĢõ¼žµÄøıä¶ŌĘä·“Ó¦ĖŁĀŹ¼øŗõĪŽÓ°ĻģµÄŹĒ
¢ŁŌö¼ÓCµÄĮæ ¢Ś±£³ÖĢå»ż²»±ä£¬³äČėN2Ź¹ĢåĻµŃ¹ĒæŌö“ó
¢Ū½«ČŻĘ÷µÄĢå»żĖõŠ”Ņ»°ė ¢Ü±£³ÖŃ¹Ēæ²»±ä£¬³äČėN2Ź¹ČŻĘ÷Ģå»ż±ä“ó£®
A£®¢Ł¢Ü B£®¢Ł¢Ś C£®¢Ś¢Ū D£®¢Ś¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĖ®ŌŚ25”ęŗĶ95”ꏱ£¬ĘäµēĄėĘ½ŗāĒśĻßČēÓŅĶ¼ĖłŹ¾£ŗ
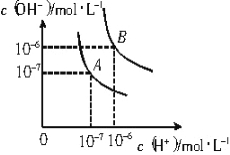
(1)Ōņ25”ꏱĖ®µÄµēĄėĘ½ŗāĒśĻßÓ¦ĪŖ (Ģī”°A”±»ņ”°B”±)£¬ĒėĖµĆ÷ĄķÓÉ ”£
(2)95”ꏱ£¬Čō10Ģå»żpH1= aµÄijĒæĖįČÜŅŗÓė1Ģå»żpH2= bµÄijĒæ¼īČÜŅŗ»ģŗĻŗóČÜŅŗ³ŹÖŠŠŌ£¬Ōņ»ģŗĻĒ°£¬øĆĒæĖįµÄpH1ÓėĒæ¼īµÄpH2Ö®¼äÓ¦Āś×ćµÄ¹ŲĻµŹĒ__________________”£
(3)25”ꏱ£¬½«pH = 11µÄNaOHČÜŅŗÓėpH = 4µÄH2SO4ČÜŅŗ»ģŗĻ£¬ČōĖłµĆ»ģŗĻČÜŅŗµÄpH = 10£¬ŌņNaOHČÜŅŗÓėH2SO4ČÜŅŗµÄĢå»ż±ČĪŖ__________________”£
(4)ĒśĻßB¶ŌÓ¦ĪĀ¶ČĻĀ£¬pH = 2µÄijHAČÜŅŗŗĶpH = 10µÄNaOHČÜŅŗµČĢå»ż»ģŗĻŗ󣬻ģŗĻČÜŅŗµÄpH = 5”£Ēė·ÖĪöĘäŌŅņ£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃŠ¾æ·¢ĻÖ£¬æÕĘųÖ®ÖŠÉŁĮæµÄNO2ÄܲĪÓėĮņĖįŠĶĖįÓźµÄŠĪ³É£¬·“Ó¦¹ż³ĢČēĻĀ£ŗ
¢ŁSO2+NO2£½SO3+NO ¢ŚSO3+H2O£½H2SO4 ¢Ū2NO+O2£½2NO2 NO2ŌŚÉĻŹö¹ż³ĢÖŠµÄ×÷ÓĆ£¬ÓėH2SO4ŌŚĻĀĮŠ±ä»ÆÖŠµÄ×÷ÓĆĻąĖʵďĒ
A. ³±ŹŖµÄĀČĘųĶعżŹ¢ÓŠÅØH2SO4µÄĻ“ĘųĘæ B. Įņ»ÆĒāĶØČėÅØH2SO4ÖŠ
C. ÅØH2SO4µĪČėÓ©ŹÆÖŠ£¬¼ÓČČ D. ¼ÓČėÉŁĮæH2SO4Ź¹ŅŅĖįŅŅõ„Ė®½ā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧÓėÉś»īĻ¢Ļ¢Ļą¹Ų£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ³ų·æÓĆĘ·ÖŠŹ³“×ŗĶ“æ¼ī¶¼ŹōÓŚČõµē½āÖŹ B. µķ·ŪŹĒĢģČ»øß·Ö×Ó£¬µķ·ŪČÜŅŗŹōÓŚ½ŗĢå
C. æÕĘųŹĒÓɼøÖÖµ„ÖŹ¹¹³ÉµÄ»ģŗĻĪļ D. ŹÆÓĶµÄ·ÖĮó”¢ĆŗµÄøÉĮó¶¼ŹōÓŚĪļĄķ±ä»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹµÄ·ÖĄą½į¹ūČ«²æÕżČ·µÄŹĒ£Ø £©
A. Ė®ĆŗĘų-»ģŗĻĪļ””µØ·Æ-“æ¾»Īļ””³ōŃõ-µ„ÖŹ
B. “æ¼ī-¼ī””Įņ»ÆĒā-Ėį””Š”ĖÕ“ņ-ĖįŹ½ŃĪ
C. ÓĶÖ¬-øß·Ö×Ó»ÆŗĻĪļ ĻĖĪ¬ĖŲ-ĢģČ»øß·Ö×Ó»ÆŗĻĪļ ÓŠ»ś²£Į§-ŗĻ³Éøß·Ö×Ó»ÆŗĻĪļ
D. ŅŗĀČ-·Ēµē½āÖŹ ””ĮņĖį±µ-Ēæµē½āÖŹ”” “×Ėį-Čõµē½āÖŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶعż¶ŌĆŗµÄ×ŪŗĻĄūÓĆæɵƵ½½ą¾»µÄČ¼ĮĻŗĶ¶ąÖֻƹ¤ŌĮĻ£¬Ņ²æɼõÉŁ»·¾³ÄŲĪŪČ¾”£ĆŗµÄ¼ä½ÓŅŗ»ÆæɵƵ½¼×“¼”£
£Ø1£©ŅŃÖŖ£ŗCH3OH”¢H2µÄČ¼ÉÕČČ£Ø”÷H£©·Ö±šĪŖ£726.5kJ/mol”¢£285.8kJ/mol£¬Ōņ³£ĪĀĻĀCO2ŗĶH2·“Ӧɜ³ÉCH3OHŗĶH2OµÄČČ»Æѧ·½³ĢŹ½ŹĒ____________”£
£Ø2£©Ņ»¶ØĢõ¼žĻĀ£¬COŗĶH2ŗĻ³ÉCH3OH£ŗCO(g)+2H2(g)![]() CH3OH(g)”£
CH3OH(g)ӣ
¢ŁŌŚĢå»żŅ»¶ØµÄĆܱÕČŻĘ÷ÖŠ°“ĪļÖŹµÄĮæÖ®±Č1:2³äČėCOŗĶH2£¬²āµĆĘ½ŗā»ģŗĻĪļÖŠCH3OHµÄĢå»ż·ÖŹżŌŚ²»Ķ¬Ń¹ĒæĻĀĖęĪĀ¶ČµÄ±ä»ÆČēĶ¼ĖłŹ¾”£
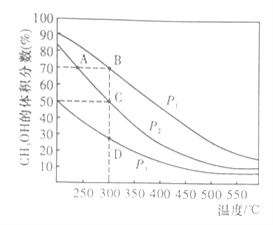
A”¢B”¢CČżµćĘ½ŗā³£ŹżKA”¢KB”¢KCµÄ“󊔹ŲĻµŹĒ___________£»Ń¹Ēæ£ŗP1____P2£ØĢī”°£¾”±”¢”°£¼”±»ņ”°=”±£©
Äę·“Ó¦ĖŁĀŹ£ŗvÄę(A)______vÄę(B)£ØĢī”°£¾”±”¢”°£¼”±»ņ”°=”±£©
ŌŚCµć£¬COµÄ×Ŗ»ÆĀŹĪŖ__________£»
ŌŚCµć£¬ČōŌŁ°“ĪļÖŹµÄĮæÖ®±Č1:2³äČėŅ»¶ØĮæµÄCOŗĶH2£¬µ±ĘäĖüĢõ¼ž²»±ä£¬“ļµ½ŠĀµÄĘ½ŗāŹ±£¬CH3OHµÄĢå»ż·ÖŹż__________£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
¢ŚČōŌŚŗćĪĀŗćČŻĢõ¼žĻĀ£¬ÄܱķŹ¾øĆæÉÄę·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄÓŠ__________”£
A. »ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä
B. »ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ±£³Ö²»±ä
C. ČŻĘ÷ÄŚµÄŃ¹Ēæ±£³Ö²»±ä
D. µ„Ī»Ź±¼äÄŚĆæĻūŗÄ1molCOµÄĶ¬Ź±£¬Éś³É2molH2
E. CO”¢H2”¢CH3OHµÄÅØ¶Č±£³Ö²»±ä
F. CO”¢H2”¢CH3OHµÄÅضČÖ®±ČĪŖ1:2:1
£Ø3£©ĒāĮņĖį”¢Ģ¼Ėį¾łĪŖ¶žŌŖČõĖį£¬Ęä³£ĪĀĻĀµÄµēĄė³£ŹżČēĻĀ±ķ£ŗ
H2CO3 | H2S | |
Ka1 | 4.4”Į10£7 | 1.3”Į10£7 |
Ka2 | 4.7”Į10£11 | 7.1”Į10£15 |
ĆŗµÄĘų»Æ¹ż³ĢÖŠ²śÉśµÄÓŠŗ¦ĘųĢåH2SæÉÓĆ×ćĮæµÄNa2CO3ČÜŅŗĪüŹÕ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________£»³£ĪĀĻĀ£¬0.1mol”¤L£1NaHCO3ČÜŅŗŗĶ0.1mol”¤L£1NaHSČÜŅŗµÄpHĻą±Č£¬pH½ĻŠ”µÄĪŖ______ČÜŅŗ£ØĢī»ÆѧŹ½£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ×Ŗ»ÆŠčŅŖ¼ÓČėŃõ»Æ¼Į²ÅÄÜŹµĻֵďĒ£Ø £©
A.H2S SO2
B.H2SO4 SO2
C.SO2 SO32©
D.SO32© SO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚŗĻ½šµÄĖµ·Ø²»ÕżČ·µÄŹĒ( )
A. Ó²ĀĮ±Č“æĀĮµÄÓ²¶ČµĶ B. ŗĻ½šÖŠæÉŅŌŗ¬ÓŠ·Ē½šŹōŌŖĖŲ
C. ĒąĶŹĒŅ»ÖÖĶĪżŗĻ½š D. “¢ĒāŗĻ½šŹĒŅ»ĄąÄÜ“óĮæĪüŹÕH2³É½šŹōĒā»ÆĪļµÄ²ÄĮĻ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com