
选择常用仪器,用较简便的方法证实氢氧化钡与硫酸的反应是离子反应。要求画出简单的实验装置图,并写出实验操作步骤。
(1)如右图连接实验装置。

(2)把一定体积的氢氧化钡溶液加入烧杯中,并将H2SO4加入到酸式滴定管中。
(3)接通直流电源,发现灯泡明亮。因为Ba(OH)2是强电解质,在溶液中完全电离出Ba2+和OH-,其溶液所以容易导电。
(4)将滴定管中的H2SO4逐滴加入烧杯中的溶液里,结果灯泡由亮逐渐变暗,直至熄灭。此时继续滴加H2SO4,灯泡又逐渐明亮。
(5)结论:由灯泡“亮![]() 暗
暗![]() 亮”的变化可知溶液中的离子浓度由“高
亮”的变化可知溶液中的离子浓度由“高![]() 低
低![]() 高”变化,从而证明了Ba(OH)2与H2SO4的反应是离子反应。
高”变化,从而证明了Ba(OH)2与H2SO4的反应是离子反应。
本题通过理论联系实际问题,主要考查离子反应的实质,并用化学实验的方法加以解决。硫酸与氢氧化钡的反应离子方程式为:2H++![]() +Ba2++2OH-====BaSO4↓+2H2O,由离子方程式可知,反应前后,溶液中自由移动的离子浓度发生明显变化。而离子浓度的变化可用溶液的导电性实验来证明。
+Ba2++2OH-====BaSO4↓+2H2O,由离子方程式可知,反应前后,溶液中自由移动的离子浓度发生明显变化。而离子浓度的变化可用溶液的导电性实验来证明。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:志鸿系列训练必修一化学人教版 人教版 题型:058
选择常用仪器,用较简便的方法证实氢氧化钡与硫酸的反应是离子反应.要求画出简单的实验装置图,并写出实验操作步骤.
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可和SO2反应,反应式可能为:2Na2O2+2SO2=====2Na2SO3+O2,为此设计如下一套装置,来验证Na2O2和SO2的反应产物。
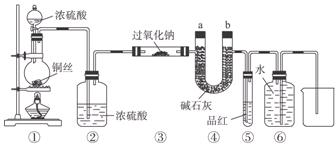
如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸。完成下列问题:
(1)点燃①处酒精灯,不久,观察到①处产生大量气体;③处硬质玻璃管的管壁发热,管内药品的颜色变化为由___________色逐渐变为___________色。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?
_______________________________________________________________________________。
(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
_______________________________________________________________________________。
(4)待反应结束后,取硬质玻璃管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
_______________________________________________________________________________。
(5)待反应结束后,取硬质玻璃管内少量固体,装入试管中,加入足量盐酸溶液,无气体放出,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com