

���� ��1��ͨ��״���һ��Ϊԭ��صĸ���������������Ӧ���״��ڼ��������±���������̼������ӣ�
��2������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ���������������A�缫Ϊ��������Һ�е�����������ʧ�������������������缫��Ӧ�͵����غ����õ���
��3��C�缫Ϊ������D�缫Ϊ���������ݱ�ͼ��֪��Һ�������ֽ��������ӣ������ݱ��ijɷֿ�֪��Һ��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����C�缫��Cu��������D�缫��ʯī������������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯ȷ�����߶�Ӧ�����ӣ����ת�Ƶ��ӵ����ʵ������㣮
��� �⣺��1���״�ȼ�ϵ����ԭ��ط�Ӧ���״��ڸ���ʧ���ӷ���������Ӧ���缫��ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
��2������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ����������������������������ʵ���ΪX����Һ��ͭ�������ʵ���Ϊ0.1mol���缫��ӦΪ��
Cu2++2e-=Cu��
0.1mol 0.2mol
2H++2e-=H2����
2x x
A�缫Ϊ��������Һ�е�����������ʧ���������������缫��ӦΪ��
4OH--4e-=2H2O+O2����
4x x
���ݵ�ʧ�����غ�õ�0.2+2x=4x��
x=0.1mol
����A�����������������������ʵ���Ϊ0.1mol���ڱ�״���µ����Ϊ2.24L��
�ʴ�Ϊ��2.24L��
��3������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ͭ���Ӵ������࣬���������ʵ�����С�������������ӣ��ʢ�ΪFe3+����ΪFe2+����ΪCu2+��
��ͼ��֪����ת��Ϊ0.4mol������Cu2+���ʵ���Ϊ0.2mol�������缫��ӦFe3++e-=Fe2+����Ӧ��������Һ����Fe2+Ϊ0.5mol��Cu2+Ϊ0.2mol��������Ҫ����NaOH��Һ0.5��2+0.2��2=1.4mol����������NaOH��Һ�����Ϊ$\frac{1.4}{5}$=0.28L=280mL��
�ʴ�Ϊ��Fe2+��280��
���� �����ۺ�ԭ��ص��ԭ���Լ���ԭ���֪ʶ��Ϊ��Ƶ���㣬�ۺ���ǿ���Ѷȴ���Ҫ����ѧ������������������Ǹ߿����ȵ�ϰ�⣬����ʱע�����缫����ʽ����д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ͨ��Ʒ����Һ����Һ�Ժ�ɫ�����Ⱥ��Ϊ��ɫ | |
| B�� | ����Һ�м���������ˮ���ٵμ�KSCN��Һ������Һ��죬��֤��ԭ��Һ��һ������Fe2+ | |
| C�� | ��ʪ��ĺ�ֽ���Ž�ʢ�������ļ���ƿ�У���ֽ����ɫ | |
| D�� | �����Ը��������Һ�еμ�Na2SO3��Һ����Һ�����Ա仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ij��Һ�м���ϡ�����ữ���ٵ���BaCl2��Һ��������ɫ��������ԭ��Һ��һ����SO42- | |
| B�� | ��ij��Һ�м���ϡ�����ữ���ٵ���AgNO3��Һ��������ɫ��������ԭ��Һ��һ����Cl- | |
| C�� | ��ij��Һ�м���̼������Һ��������ɫ�������ٵ���ϡ���ᣬ�����ܽ⣬��ԭ��Һ��һ����Ca2+ | |
| D�� | �ù��IJ�˿պȡij��ɫ��Һ���ھƾ�������������ʱ�۲쵽��ɫ���棬��ԭ��Һ��һ����Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 Ǧ���صĵ���ܷ�ӦʽΪ��
Ǧ���صĵ���ܷ�ӦʽΪ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | FeCl3 | B�� | Cu��NO3��2 | C�� | Na2SO3 | D�� | Al2��SO4��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
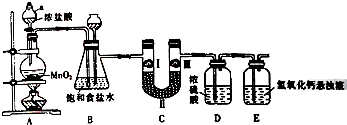 �����ڹ�ũҵ������Ӧ�÷dz��㷺����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã�
�����ڹ�ũҵ������Ӧ�÷dz��㷺����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã�| ѡ�� | a | b | c |
| �� | ʪ�����ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
| �� | ��ʯ�� | Ũ���� | ��ˮ�Ȼ��� |
| �� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 LHF�з�������ΪNA | |
| B�� | �����£�31.0g�����к��еĹ��ۼ���ĿΪ1.5NA | |
| C�� | ���³�ѹ�£�17 g����-14CH3�������ĵ�����Ϊ9NA | |
| D�� | .��1molCl2ͨ�뵽ˮ�У���N��HClO��+N��Cl-��+N��ClO-��=2NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com