
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
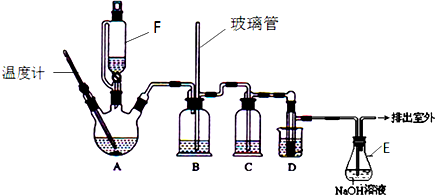
分析 (1)A中主要发生的是乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,必须注意反应温度.乙烯与液溴发生加成反应生成1,2-二溴乙烷;
(2)依据当堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(3)c中放氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;
(4)反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用E中NaOH溶液吸收;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(6)1,2-二溴乙烷的凝固点较低(9℃).
解答 解:(1)乙醇在170℃时发生消去生成乙烯,温度必须是170℃,反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,D中是乙烯与液溴发生加成反应生成1,2-二溴乙烷,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br2→CH2BrCH2Br;
(2)发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
(3)制取乙烯中产生的杂质气体二氧化碳和二氧化硫等酸性气体用氢氧化钠溶液吸收,故答案为:c;
(4)该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置E中氢氧化钠溶液的作用是吸收HBr和Br2等气体,防止大气污染,
故答案为:吸收挥发出来的溴,防止污染环境;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(6)1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞,
故答案为:1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法,培养学生分析问题、理解能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取碘水中的碘,后分液,水层从上口倒出 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 三氯化铁溶液滴入氢氧化钠溶液可制备氢氧化铁胶体 | |
| D. | 可用量筒准确量取9.5ml水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、棉花、PVC、淀粉、涤纶都是由高分子组成的物质 | |
| B. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| C. | 雾霾天气的造成与PM2.5指数有着重要的关系,PM2.5是指大气中直径小于或等于2.5pm(皮米)的颗粒物 | |
| D. | 将废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | |
| 开始沉淀时 | 3.8 | 5.8 | 2.2 | 10.6 |
| 完全沉淀时 | 4.7 | 8.3 | 4.0 | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 吸收y mol H2只需1 mol MHx | |
| B. | 平衡时容器内气体压强减小 | |
| C. | 若降温,该反应的平衡常数增大 | |
| D. | 若向容器内通入少量氢气,则v(放氢)>v(吸氢) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com