
设NA为阿伏加德罗常数的值,下列说法正确的是
A.18 g H2O中含NA个质子
B.1 L 1 mol·L一1的CuSO4溶液中含NA个Cu2+
C.常温常压下,2.24 L Cl2中含0.2NA个氯原子
D.0.5 mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是
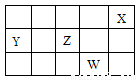
A.原子半径的大小顺序: r(W) >r(Z)> r(Y)
B.Y、Z的氢化物有可能含非极性键
C.Z、W形成的化合物W显负价
D.Y分别与Z、W形成的化合物全部都是非极性分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
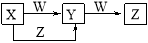
A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市通州区高三模拟考试(一)理综化学试卷(解析版) 题型:选择题
下列解释实验事实的方程式不正确的是
A.葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖) 6C + 6H2O
6C + 6H2O
B.向AgNO3溶液中加入过量Na2S溶液后,再加入NaCl溶液,黑色沉淀变成白色:Ag2S + 2Cl- = 2AgCl↓ + S2
C.将NH3通入滴有酚酞的水中,溶液变红:NH3 + H2O NH3·H2O
NH3·H2O
 + OH-
+ OH-
D.明矾的水溶液pH<7:Al3+ + 3H2O Al(OH)3(胶体) + 3H+
Al(OH)3(胶体) + 3H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三4月质量检查理综化学试卷(解析版) 题型:选择题
往某恒温密闭容器中加入CaCO3,发生反应:
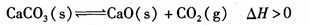
反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是
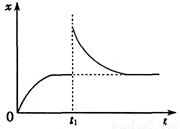
A.v逆 B.c(CO2)
C.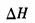 D.
D.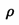 (容器内气体密度)
(容器内气体密度)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三4月月考理综化学试卷(解析版) 题型:填空题
(14分)氮及氮的化合物在生产生活中有着重要的用途,NH3、HNO3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
① 2C + O2 → 2CO
② C + H2O(g) → CO + H2
③ CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x= m3,实际消耗了_____ kg焦炭。
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
(2)汽车尾气会排放氮的氧化物污染环境。已知气缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) △H>0
2NO(g) △H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol,计算该温度下的平衡常数K= (写出表达式,并计算出结果);汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
(3)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(4)25℃时,电离平衡常数:
化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
电离平 衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
回答下列问题:
a.常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是 。
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+)=c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)=c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)=c(OH-) + c(CO32-)
b.0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(列出计算式)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三4月月考理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
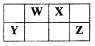
A.W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B.Z元素的最高价氧化物水化物的酸性强于Y
C.四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D.向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高三3月教学质量监测理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构基础】(15分)近年来,科学家新发现了一些含有碳、氮、硫、铜元素的物质,回答下列问题。
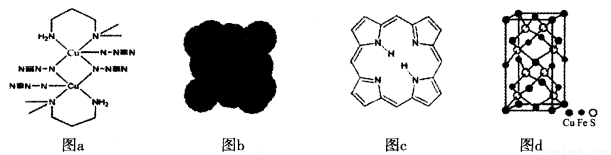
(1)电负性:C_______N(填“>”或“<”)。
(2)图a是某种铜盐配合物的结构,基态铜原子的价电子排布式为_______________,该配合物中铜元素的价态为_______________________。
(3)新的星际分子氰基辛四炔的结构为:H—C≡C—C≡C—C≡C—C≡C—C≡N,氰基辛四炔分子的构型为__________;分子中σ键与π键数目之比为__________________。
(4)C60晶体(图b)中与每个C60紧邻的C60分子有________个;C60易溶于CS2溶剂中,原因是________;设C60晶胞边长为a pm,则C60晶体密度为_____________g·cm-3。
(5)卟吩分子内存在氢键,在图c中用(…)画出氢键结构。
(6)写出图d中表示物质的化学式_________________________,该物质煅烧可冶炼铜,同时产生氧化亚铁,氧化铁和二氧化硫,且生成的氧化亚铁与氧化铁的物质的量之比为2 :1,请写出反应的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省黄山市高三毕业班第二次质量检测理综化学试卷(解析版) 题型:选择题
溶液中,有关物质的量浓度关系正确的是
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3—)
B.1.0 mol.L-1·Na2C2O4溶液:c(OH-)=c(HC2O4—)十c(H+)+ c(H2C2O4)
C.pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+)
D.将0.2 mol.L-1的某一元酸HA溶液和0.1 mol.L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A一)=c(H+)+c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com