
| A. | 钠与水的反应 | |
| B. | 灼热的炭与二氧化碳反应生成一氧化碳 | |
| C. | 高炉炼铁 | |
| D. | 氢氧化钠溶液与稀盐酸的反应 |
分析 属于离子反应,说明该溶液中有离子参加,属于氧化还原反应,说明该反应中有电子转移,其特征是有化合价升降,据此分析解答.
解答 解:A.该反应中有电子转移、有离子参加,所以属于离子反应和氧化还原反应,故A正确;
B.灼热的炭与二氧化碳反应生成一氧化碳,该反应中有电子转移,属于氧化还原反应,没有离子参加,不属于离子反应,故B错误;
C.高炉炼铁,该反应中有电子转移,属于氧化还原反应,没有离子参加,不属于离子反应,故C错误;
D.该反应是在溶液中进行,有离子参加,属于离子反应,没有电子转移,不属于氧化还原反应,故D错误;
故选A.
点评 本题考查离子反应、氧化还原反应,侧重对基本概念的考查,根据离子反应、氧化还原反应的概念分析解答即可,注意氧化还原反应本质和特征的区别.


科目:高中化学 来源: 题型:选择题
| A. | 焓变是指在恒压、恒温下,体系不做体积功,只做其它功的变化过程的热效应 | |
| B. | 书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热 | |
| C. | 化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的 | |
| D. | 吸热反应的△H<0,放热反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
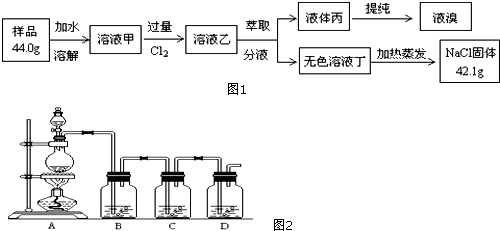
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
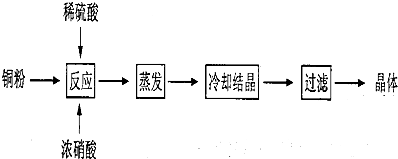
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LO2含有的O2分子个数为NA | |
| B. | 在标准状况下,4.48L H2O中所含的原子总数为0.6NA | |
| C. | 40 g NaOH溶解在1 L水中,所制得的溶液,物质的量浓度为1mol•L-1 | |
| D. | 常温常压下,22g CO2含有的原子个数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1mol H-H键和1 mol I-I键所需能量大于断开2mol H-I键所需能量 | |
| C. | 断开2mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2akJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
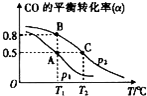 SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.
SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
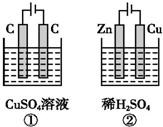 如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 产生气体的总体积:①>② | |
| B. | 电极上析出物质的总质量:②>① | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | ①中阳极的电极反应式:4OH--4e-═2H2O+O2↑;②中阴极的电极反应式:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1K2SO4溶液中含有K+的数目为2NA | |
| B. | 标准状况下,2.24L氯仿(CHCl3)中含有C-Cl数目为0.3NA | |
| C. | 18g重水中所含有的中子数为10NA | |
| D. | 1molNa与O2在一条条件下反应生成Na2O和Na2O2的混合物的转移电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com