
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
2011年3月,日本发生9级地震,地震引发海啸及伤亡。灾区重建面临多种困难,其中饮水安全是重要问题之一。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
(1)高铁酸钾中铁元素的化合价为_______价,推测它具有的化学性质是____ __。
(2)在次氯酸钠(NaClO,84消毒液的主要成分)溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。发生的离子反应为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,氧化剂是________。将KOH加入到反应后的溶液搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为2KOH+Na2FeO4====K2FeO4+2NaOH。根据复分解反应原理,高铁酸钠的溶解度________高铁酸钾的溶解度(填“大于”、“小于”或“等于”)。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬)。有关离子方程式为FeO42-+CrO2-+2H2O====CrO42-+Fe(OH)3↓+OH-,2CrO42-+2H+====Cr2O72-+H2O,Cr2O72-+6Fe2++14H+====2Cr3++6Fe3++7H2O
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液30.00 mL。计算上述实验制得的样品中,高铁酸钾的质量分数为__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是 ( )
A.向粗盐溶液中滴加盐酸和BaCl2溶液,产生白色沉淀,则说明粗盐中含有SO42-
B.向精盐溶液中滴加盐酸和BaCl2溶液,无明显现象,则说明精盐中不含SO42-
C.向蒸馏水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明蒸馏水中含有Cl-
D.向自水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明自水中含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
现用0.10 mol·L-1HCl溶液滴定10 mL 0.05 mol·L-1NaOH溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
A.10 mL B.5 mLC.小于5 mL D.大于5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
_____________________________________________________________________
(2)碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________
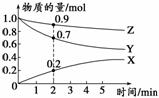 (3)某温度时,在2 L容器中X、Y、Z三种气体的物质的
(3)某温度时,在2 L容器中X、Y、Z三种气体的物质的
量随时间变化的曲线如图所示。由此分析,该反应的化
学方程式为___________________________________;
从反应开始至2 min时,Z的反应速率为____________。
(4)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=10。在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为若加水稀释至1000L,则溶液的pH为。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
A.[Al(OH)4]- B.Cu2+ C.Al3+ D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属材料的说法正确的是( )
A.铁和钢材的主要化学成分相同,性质也相同
B.硬铝(Al-Cu-Mg-Mn-Si合金)可用于制造耐高温门窗
C.黄铜矿(CuFeS2)可冶炼出Cu、Fe,同时可制取硫酸
D.铁矿石是一种可再生资源,没有必要进行开采限制
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热),反应达到平衡后,此时将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。
2SO3(正反应放热),反应达到平衡后,此时将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。
(1)求该反应达到平衡时SO2的转化率____ __(用百分数表示)。
(2)判断该反应达到平衡状态的标志是_______。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(3)欲提高SO2的转化率,下列措施可行的是_______。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(4)若保持容积不变,当达到平衡时充入氩气,平衡将 (填“正向”“逆向”或“不移动”)。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“正向”“逆向”或“不”)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com