
| A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA |
| B.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA |
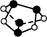
| D.0.5 mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S—S键 |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源:不详 题型:单选题
| A.16O2与18O2互为同分异构体 |
| B.16O与18O核外电子排布方式不同 |
| C.通过化学变化可以实现16O与18O间的相互转化 |
| D.标准状况下,1.12 L16O2和1.12 L18O2均含0.1NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在1L1mol?L-1的盐酸溶液中含有NA个HCl分子 |
| B.假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA |
| C.标准状况下,11.2 L CCl4中含有的C—Cl 键的个数为2NA |
| D.46gNO2和N2O4混合气体降温到标况,其中含有原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 甲 | 物质的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
| 乙 | 阿伏加德罗常数 | 标准状况下的气体体积 | 固体的密度 | 溶液的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,30 L pH=11的Na2CO3溶液中含有的OH-数为0.03NA |
| B.用含有0.1 mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
| C.25℃时,pH=13的1LBa(OH)2溶液中含有的OH-数为0.2NA |
| D.100 mL 12 mol·L-l浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2个 | B.3个 | C.4个 | D.5个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com