

分析 (1)黄铁矿氧化过程中反应物为FeS2、氧气、水,生成物为Fe2(S04)3和硫酸,根据反应物和生成物书写化学反应方程式;
(2)①Cu2S中Cu元素的化合价由+1升高为+2,S元素的化合价由-2升高为+6,Fe元素的化合价由+3价降低为+2,根据转移电子守恒、原子守恒配平方程式;
②铁还原铜离子得铜单质;
(3)SO2用过量氨水吸收,可以得到亚硫酸铵;
(4)①电解精练铜的阴极反应为铜离子得到电子生成铜单质;
②根据细菌冶金过程中涉及的反应条件及所用物质可知,细菌冶金可以降低能源消耗,利于减少污染,对贫矿和尾矿的开采更有价值,据此答题;
解答 解:(1)黄铁矿氧化过程中反应物为FeS2、氧气、水,生成物为Fe2(S04)3和硫酸,化学反应方程式为4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04 ,
故答案为:4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04 ;
(2)①Cu2S中Cu元素的化合价由+1升高为+2,S元素的化合价由-2升高为+6,Fe元素的化合价由+3价降低为+2,再据电荷守恒确定产物为H+,则该离子反应为Cu2S+10Fe3++4H2O$\frac{\underline{\;细菌\;}}{\;}$2Cu2++10Fe2++8H++S042-,
故答案为:1;10;4;2;10;8H+;1;
②铁还原铜离子得铜单质,反应的离子方程式为Fe+Cu2+=Cu+Fe2+,
故答案为:Fe+Cu2+=Cu+Fe2+;
(3)SO2用过量氨水吸收,可以得到亚硫酸铵,反应的化学方程式为SO2+2NH3•H2O=(NH4)2SO3+H2O,
故答案为:SO2+2NH3•H2O=(NH4)2SO3+H2O;
(4)①电解精练铜的阴极反应为铜离子得到电子生成铜单质,阴极电极反应式为Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
②根据细菌冶金过程中涉及的反应条件及所用物质可知,细菌冶金的优点为可以降低能源消耗,利于减少污染,对贫矿和尾矿的开采更有价值,
故答案为:可以降低能源消耗,利于减少污染,对贫矿和尾矿的开采更有价值.
点评 本题考查了冶炼铜两种方案设计与评价,掌握铜及其化合物性质,理清各流程反应是解答的关键,明确发生的反应及反应中元素的化合价变化即可解答,侧重分析与应用能力的考查,题目难度中等.


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2016-2017学年山西省高二上10月月考化学试卷(解析版) 题型:选择题
在一定条件下,下列药物的主要成分都能发生四种反应的是
①取代反应 ②加成反应 ③水解反应 ④中和
A.维生素B5: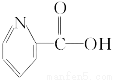
B.阿司匹林:
C.芬必得:
D.摇头丸:
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
已知S、SO2、SO3三种物质的质量比为2:4:5,它们的物质的量之比为
A.10:5:4 B.5:4:2 C.2:4:5 D.1:1:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
实验室中需要配制0.2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是(  )
)
A.950mL,11.2g B.500mL,11.7g C.1000mL,11.7g D.任意规格,11.12g
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由热电站提供电力电解水产生氢 | |
| B. | 用铁和盐酸反应放出氢气 | |
| C. | 利用太阳能在一定条件下使水分解产生氢气 | |
| D. | 以焦炭和水制取水煤气(含CO和H2)后分离出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO3+H2O═H2SO4 | ||
| C. | 2F2+2H2O═4HF+O2↑ | D. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com