
| A、FeCl2溶液 |
| B、溴水 |
| C、酸性高锰酸钾溶液 |
| D、NaOH溶液 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、氢氧化钡与稀硫酸混合:SO42-+H++OH-+Ba2+=H2O+BaSO4↓ |
| B、碳酸氢钠溶液与NaOH溶液混合:HCO3-+OH-=H2O+CO32- |
| C、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D、氧化铜与盐酸反应 O2-+2H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )| A、D与C不能形成化合物 |
| B、D的最高正价与B的最高正价相等 |
| C、A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A |
| D、A、B、C、D原子所具有的原子轨道类型和数目都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、Q1=Q2=98.32 |
| B、Q1>Q2>98.32 |
| C、Q2<Q1<98.32 |
| D、Q1<Q2<98.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
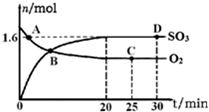 硫的化合物在生产和科研中发挥着重要作用.
硫的化合物在生产和科研中发挥着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com