
 .
.分析 (1)3BrF3+5H2O═HBrO3+Br2+9HF+O2中,Br元素的化合价分别由+3价升高为+5价、由+3价降低为0,O元素的化合价由-2价升高为0;
(2)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中Zn元素的化合价升高,As元素的化合价降低,该反应转移电子为12e-;
(3)①2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,NaClO3为氧化剂,HCl为还原剂,只有一半HCl作还原剂;
②得到相同条件下相同体积的ClO2气体,设均生成2mol,方法一中作还原剂的HCl为2mol,方法二中作还原剂的H2O2为1mol;
解答 解:(1)当有5mol水参加反应时,O元素化合价由-2价升高到0价,2mol水被氧化,失去4mol电子,Br元素化合价由+3价降低到0价,则由H2O还原的BrF3为$\frac{4mol}{3-0}$=$\frac{4}{3}$mol,
故答案为:$\frac{4}{3}$mol;
(2)①As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中Zn元素的化合价升高,As元素的化合价降低,该反应转移电子为12e-,用双线桥法标出电子转移的方向和数目为 ,
,
故答案为: ;
;
②若生成0.2mol AsH3,由As元素的化合价由+3价降低为-3价可知转移的电子数为0.2mol×6×NA=1.2NA,
故答案为:1.2NA;
(3)①2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,NaClO3为氧化剂,HCl为还原剂,只有一半HCl作还原剂,由反应可知氧化剂与还原剂的物质的量之比为2mol:2mol=1:1,
故答案为:1:1;
②得到相同条件下相同体积的ClO2气体,设均生成2mol,方法一中作还原剂的HCl为2mol,方法二中作还原剂的H2O2为1mol,可知两方法中消耗的还原剂质量之比为2mol×36.5g/mol:1mol×34g/mol=73:34,
故答案为:73:34.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子转移计算、物质的量的有关计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
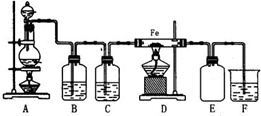 实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:
实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 [Al(OH)2]++H+.
[Al(OH)2]++H+.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 同一弱电解质溶液,温度不同时,导电能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 间二甲苯的二氯代物有5种 | |
| B. | 二氯甲烷有2种同分异构体 | |
| C. | 丙烯分子中所有的原子有可能在同一平面上 | |
| D. | 用-C4H9取代苯环上的1个氢原子,最多可得4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com