
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
【答案】A
【解析】
A、正戊烷和异丁烷互为同分异构体,由表格正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,则正戊烷的燃烧热大于异戊烷,即正戊烷的燃烧热大于3531.3KJ/mol,故A正确;B.相同质量的烷烃,氢的质量分数越大,燃烧放热越多,故B错误;C.由表格的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,正丁烷转化为异丁烷为放热反应,△H<0,故C错误;D、根据燃烧热的含义:完全燃烧1mol甲烷生成二氧化碳和液态水时会放出891.0KJ的热量,所以热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-891.0kJ/mol,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6. 02×1023个分子所占的体积约是22. 4 L
②0. 5 mol H2所占体积为11. 2 L
③标准状况下,1 mol H2 O的体积为22.4 L
④标准状况下,28 g CO与N2的混 合气体的体积约为22. 4 L
⑤各种气体的气体摩尔体积都 约为22. 4 L/mol
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤B.④⑥C.③④⑥D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)是工业上常用的硫化剂。常温下是一种液体,沸点137℃,易与水反应。实验室可通过硫与少量氯气在110140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
(1)选取以下装置制取少量S2Cl2:

①仪器m的名称为_____________。
②装置连接顺序:A→________________________________→E→D。
③A中发生反应的离子方程式为 _________________________。
④装置F的作用是____________________。
⑤D中的最佳试剂是__________(填标号)。
a.碱石灰 b.浓硫酸 c.无水氯化钙
⑥为了提高S2Cl2的纯度,关键的是控制好温度和_______________________。
(2)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合物的SO2的体积分数。

①W溶液可以是下列溶液中的__________(填标号);
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为__________(含V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
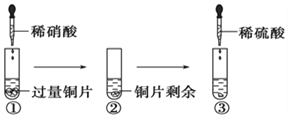
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。
(1)用铝粉去除饮用水中NO3-的一种方案如下:
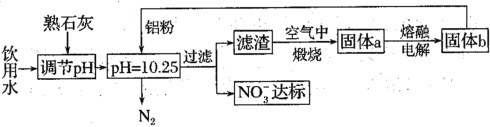
①用熟石灰而不用NaOH调节pH的主要原因是___。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程式___。
②在加入铝粉去除NO3-的反应中,氧化产物和还原产物的物质的量之比为___。
(2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓度、pH随时间的变化关系如图(部分副反应产物略去):
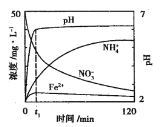
①t1时刻前,该反应的离子方程式为___。
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能的原因是___。
(3)用Pt作电极电解含NO3-的酸性废水,原理如图。N为电源的___(选填“正”或 “负”)极,与直流电源M端相连的Pt电极上的电极反应式为___。
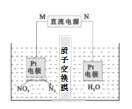
(4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO3-、SO42-的废水,可使NO3-变为NH4+。研究发现:其他条件不变,废水中加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:___,该反应中,Na2O2的作用为___(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
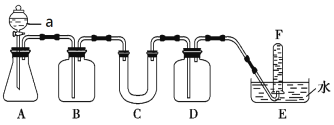
装置A是CO2气体的发生装置,请写出仪器a的名称___,B中盛饱和NaHCO3溶液,其作用是___。写出C中过氧化钠与二氧化碳反应的化学方程式___。D中盛放的试剂可以是____(填序号)。
①浓H2SO4 ②NaOH溶液 ③CaCl2溶液 ④Na2SO3溶液
(3)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)___(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。某厂为了变废为宝,将工业废水(含5.00×10-3 mol·L-1的Cr2O72-)处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验流程:
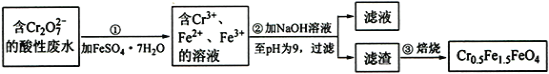
(1)第①步反应的离子方程式是_____。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有_____。
(3)为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe3+与Fe2+的比例为___。在第②步过程中,须持续通入N2,原因是____________。
(4)将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____。
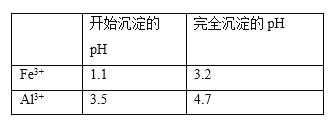
(5)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,________得到CaC12·2H2O。(在横线上补全实验步骤,实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。有关离子开始沉淀及沉淀完全时的pH见下表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3 molO2加入到V L的反应器中,在高温下放电,经t1 s建立了平衡体系:3O2![]() 2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是( )
2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是( )
A.  B.
B. 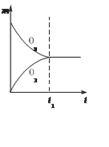
C. 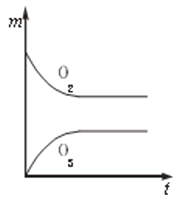 D.
D. 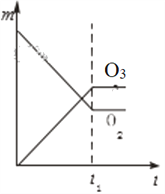
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com