
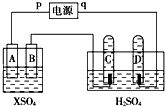
 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡,试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡,试回答:分析 (1)接通电源,金属M沉积于B极,同时C、D产生气泡,则B为阴极,M离子在阴极放电生成金属单质,则A、C是阳极,B、D是阴极,连接阳极的是电源正极;
(2)C电极是电解池阳极,阳极上氢氧根离子放电;
(3)B上金属离子得电子生成单质,A电极上X失电子生成金属阳离子;
(4)根据金属和转移电子之间的关系式计算.
解答 解:(1)接通电源,金属M沉积于B极,同时C、D产生气泡,则B为阴极,M离子在阴极放电生成金属单质,则A、C是阳极,C阳极上氢氧根离子失电子生成氧气,B、D是阴极,所以p是正极,A电极上失电子发生氧化反应,
故答案为:正;氧气;
(2)C是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(3)B上金属离子得电子生成单质,A电极上X失电子生成金属阳离子,溶液中离子浓度不变,所以溶液的pH不变,故答案为:不变;
(4)设其摩尔质量为M,
电解时,B电极上的电极反应式为:X 2++2e-=X
2mol 1mol
0.004mol $\frac{0.128g}{M}$
M=$\frac{0.128g×2mol}{0.004mol×1mol}$=64g/mol,
故答案为:64g/mol.
点评 本题涉及原电池、电解池的工作原理以及电极反应式的书写和电子守恒的应用知识,属于综合知识的考查,难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠与盐酸反应 | B. | 氧化铁与一氧化碳在高温下反应 | ||
| C. | 氧化铜与硫酸反应 | D. | 铁粉与硫酸铜溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、X、Y、Z是前四周期的常见元素,原子序数依次增大,A可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34,请回答:
A、B、X、Y、Z是前四周期的常见元素,原子序数依次增大,A可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
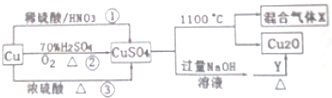
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)═c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)═2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2溶液:c(Na+)+c(Ca2+)═c(CH3COO-)+c(OH-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
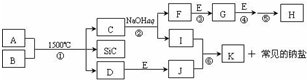 如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.
如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.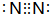 ,G的化学式NO;
,G的化学式NO;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com