
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.分析 (1)已知:反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H=+116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H=+44.0kJ/mol
由盖斯定律Ⅰ+Ⅱ-Ⅲ可得2NH3(g)+CO2(g)=CO(NH2)2 (s)+H2O(l),据此计算;再由△G=△H-T△S<0反应自发进行判断;
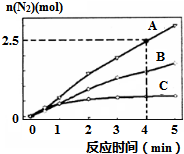
(2)①已知4分钟时氮气为2.5mol,根据v(N2)=$\frac{△c}{△t}$计算;
②A、相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B、催化剂改变反应速率不改变化学平衡;
C、单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D、该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
(3)①根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比列式;
②列出可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K,处理变形K=Ksp(AgCl)×K稳计算,;1L 1mol/L氨水中最多可以溶解AgCl可以依据化学平衡常数计算;
(4)氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2═CH-CN)的方程式为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O.
解答 解:(1)已知:反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H=+116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H=+44.0kJ/mol
由盖斯定律Ⅰ+Ⅱ-Ⅲ可得2NH3(g)+CO2(g)=CO(NH2)2 (s)+H2O(l)H=-87 kJ/mol;该反应气体分子数减少,所以△S<0,则当温度较低时,△G=△H-T△S<0;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2 (s)+H2O(l)H=-87 kJ/mol;低温;
(2)①已知4分钟时氮气为2.5mol,则生成的N2为2.5mol,所以v(N2)=$\frac{2.5mol÷2L}{4min}$=0.3125mol•L-1•min-1;
故答案为:0.3125mol•L-1•min-1;
②A、相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B、使用催化剂A达平衡时,改变反应速率不改变化学平衡,N2最终产率不变,故B错误;
C、单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D、该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①Ag+(aq)+2NH3(aq)?Ag(NH3)2+ (aq),该反应平衡常数的表达式为$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}]}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;
故答案为:$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}]}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;
②可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$$•\frac{c(A{g}^{+})}{c(A{g}^{+})}$=Ksp(AgCl)×K稳=2.50×10-10×1.00×107=2.5×10-3;
设溶解的AgCl物质的量为x,反应前后系数相同,可以用物质的量代替平衡浓度计算平衡常数,
AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq),
依据平衡常数K=$\frac{{x}^{2}}{(1-2x)^{2}}$=2.5×10-3,解得x=0.045;
故答案为:2.5×10-3;0.045;
(4)由氨、丙烯和空气为原料,一定条件下合成丙烯腈方程式为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O;
故答案为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O.
点评 本题考查了热化学方程式书写方法和盖斯定律计算应用、化学平衡影响因素分析判断、平衡常数和溶度积常数计算的应用、反应速率计算、平衡状态的判断等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨中,将氨气液化分离以提高氨气产率 | |
| B. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 两支试管中分别加入等体积5%的H3O2溶液,在其中一支试管中加入2~3滴FeCl3溶液,该试管中产生气泡快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:
为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 31.6 g高锰酸钾完全分解产生O2的体积约为2.24 L | |
| B. | 在25℃、101KPa时,24.5L氨气所含质子数约为10NA | |
| C. | 0.3 mol•L-1硫酸钠溶液中所含Na+和SO42-总物质的量为0.9 mol | |
| D. | 25℃、101KPa下,2.24 L二氧化碳与二氧化硫的混合气体中所含氧原子数约为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com