
| A. | 生石灰加水制熟石灰 | B. | 化石燃料的燃烧 | ||
| C. | 氢氧化钠溶液中滴加稀盐酸 | D. | 二氧化碳与高温的炭 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:O<S<Na | |
| B. | 碱性强弱:LiOH>KOH>CsOH | |
| C. | 还原性:HCl>HBr>HI | |
| D. | 热稳定性:H2O<NH3<SiH4的依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
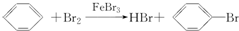
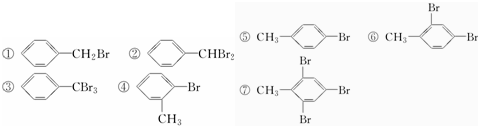
| A. | 只有①②③ | B. | 只有④⑤⑥⑦ | C. | 只有①⑤ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 12:1 | C. | 1:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| B. | 稀氨水中加入氢氧化化钠固体少量,由于氨水的电离平衡逆向移动,所以溶液的碱性减弱 | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}COO)}$ 的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于1.8mol | B. | 等于0.9mol | C. | 等于1.8mol | D. | 大于1.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸是强酸,氢硫酸是弱酸 | B. | HClO4酸性比H2SO4强 | ||
| C. | 氯气与H2S能发生置换反应 | D. | 受热时,氯化氢比硫化氢稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com