
【题目】如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左移,恢复原温度后,活塞右移并停留于容器的中央,则原来H2、O2的体积比最接近于( )
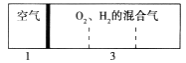
①2:7 ②5:4 ③4:5 ④7:2
A.①② B.③④ C.②④ D.①③
【答案】C.
【解析】
试题解析:反应前左右压强都相等,气体的物质的量之比等于体积之比,设空气的物质的量为1mol,则氢气、氧气的混合气体为3mol.反应后恢复至原来的温度,活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,若剩余的气体为氢气,参加反应气体共2mol,由2H2+O2=2H2O可知,氧气为2mol×1/3=2/3mol,故氢气为3mol-2/3mol=7/3mol,故H2、O2的体积比为7/3mol:2/3mol=7:2;若剩余的气体为氧气,参加反应气体共2mol,由2H2+O2=2H2O可 知,氢气为2mol×2/3=4/3mol,故氢气为3mol-4/3mol=5/3mol,故H2、O2的体积比为5/3mol:4/3mol=5:4,所以原来H2、O2的体积比最接近的为②④,
考点: 有关混合物反应的计算考查。


科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________ mol/L。
(5)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y、Z三种物质存在如图所示转化。回答下列问题。
若X为黑色固体单质,A为O2,写出Z→Y的化学方程式_________________。
②若X为NaOH溶液,则写出Y→Z的化学方程式_______________________。
(2)已知常温下在溶液中可发生如下两反应:
Ce4++Fe2+=Fe3++Ce3+;Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Ce4+、Sn4+、Fe3+三种离子的氧化性由强到弱的顺序是 。
(3)Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程。
①该反应中,被氧化的元素是_____________,氧化剂是_______________。
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ ______+ ________![]() ______+ ________+ H2O
______+ ________+ H2O
反应中若产生0.2mol的还原产物,则有_______mol电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镀锌铁在发生析氢腐蚀时,若有0.2 mol 电子发生转移,下列说法正确的是( )
①有5.6 g金属被腐蚀
②有6.5 g金属被腐蚀
③在标准状况下有2.24 L气体放出
④在标准状况下有1.12 L气体放出
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氮、碳及其化合物的研究具有重要意义。
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g)△H1K1
N2H4(g)+O2(g)=N2(g)2H2O(g)△H2K2
则2N2H4(g)+ N2O4(g)=3N2(g)+ 4H2O(g) △H= (用△H1、△H2表示),该反应的化学平衡常数K = (用K1、K2表示)
(2)汽车尾气转化反应:NO+CO→N2+CO2(未配平),将NO和CO转化为和N2和CO2,实现除污,每生成1molN2还原剂失去电子数为 。
(3) 大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间(t)测得各物质的物质的量(n)如下
N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间(t)测得各物质的物质的量(n)如下
t(min) n(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
0~10min内,NO的平均反应速率v(NO)= ;T1℃时,该反应的平均常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.恒温时,充入一定量的氦气 d.加入适量的催化剂
(4)氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O,放电时,该电池正极的电极反应式为 。
(5)不能作为判断反应达到化学平衡状态的依据是 (填字母序号)。
A.容器内CO2的浓度保持不变
B.v正(N2)=2v逆(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
A. CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B. O2(g)+4H+(aq)+4e-=2H2O(1)
C. CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e–
D. O2(g)+2H2O(1)+4e–=4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于吸热反应的说法,错误的是
A. 需要加热的反应不一定是吸热反应
B. 多数分解反应是吸热反应
C. 吸热反应一定不能自发进行
D. 盐类的水解反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9月15日22时04分09秒,长征二号FT2火箭托举着天宫二号空间实验室腾空而起,成功送上太空。该火箭所用的推进燃料偏二甲肼(化学式为C2H8N2),下列说法中正确的是
A.lmolC2H8N2中含有lmolN2
B.偏二甲肼的摩尔质量为60g
C.偏二甲肼是比液氢更环保的燃料
D.偏二甲肼燃烧时能放出大量的热和气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com