
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
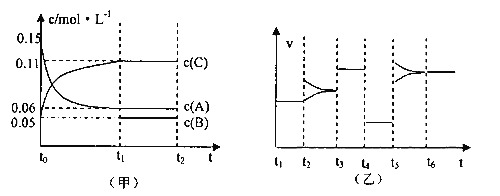
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率v(C)为=_________________。
(2)若t2—t3阶段,C的体积分数变小,此阶段v(正)_____________v(逆)(填“>”“<”“=”)
(3)t4—t5阶段改变的条件为_________________,B的起始物质量为_________________。
(4)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式_________________。
【答案】 0.004mol/(L·S < 减压 0.04 mol 3A(g)![]() 2C(g)+B(g) △H=100a kJ·mol-1
2C(g)+B(g) △H=100a kJ·mol-1
【解析】(1)若t1=15s,生成物C在t0~t1时间段的平均反应速率为:v=![]() =0.004molL-1s-1,
=0.004molL-1s-1,
(2)由图2可知t2时增大了某一物质的浓度,已知t2-t3阶段,C的体积分数变小,则增大了B的浓度,增大B的浓度平衡向逆方向移动,所以v正小于v逆;
(3)t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)![]() B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积
B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积![]() ,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol。
,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol。
(4)反应的方程式为3A(g)![]() B(g)+2C(g),A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为100akJ,由图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明向正反应方向移动,则正反应吸热,该反应的热化学方程式为3A(g)
B(g)+2C(g),A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为100akJ,由图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明向正反应方向移动,则正反应吸热,该反应的热化学方程式为3A(g)![]() B(g)+2C(g)△H=+100akJmol-1。
B(g)+2C(g)△H=+100akJmol-1。


科目:高中化学 来源: 题型:
【题目】已知下表均为烷烃分子的化学式,且它们的一氯取代物只有一种
1 | 2 | 3 | 4 | 5 | 6 | … |
CH4 | C2H6 | C5H12 | C8H18 | C17H36 | … | … |
则第6项烷烃分子的化学式
A.C16H34B.C22H46C.C26H54D.C27H56
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质可能由甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种物质组成,在进行鉴定实验时记录如下:①有银镜反应②加入新制Cu(OH)2悬浊液不溶解③滴入几滴稀氢氧化钠溶液和酚酞溶液呈红色,加热后变无色。该物质是()
A.一定有甲酸乙酯,可能有甲醇B.四种物质都有
C.有甲酸乙酯和甲醇D.有甲酸乙酯和甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 铜跟硝酸银溶液反应:Cu+Ag+===Cu2++Ag
B. 碳酸钙与盐酸反应:![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C. 硫酸与氢氧化钡溶液反应:H++![]() +Ba2++OH===BaSO4↓+H2O
+Ba2++OH===BaSO4↓+H2O
D. Ba(OH)2与CuSO4溶液反应:Cu2++![]() +Ba2++2OH===BaSO4↓+Cu(OH)2↓
+Ba2++2OH===BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞结构和功能的叙述正确的是( )
A. 细胞器在细胞质中的分布与细胞的功能无关
B. 蛋白质和RNA可以自由进出核孔,DNA不能自由进出核孔
C. 脂质和蛋白质是细胞膜的主要组成成分且蛋白质在膜上均匀分布
D. 能将无机物转化成有机物的细胞一定含有核糖体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量的Fe在1molCl2中充分燃烧,转移3NA个电子
B. 7.8gNa2O2中阴、阳离子总数为0.3NA
C. 电解精炼铜时,若转移NA个电子,则阳极减少的质量为32g
D. 反应KClO3+6HCl═KCl+3Cl2+3H2O中,若有1molH2O生成,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中的有机物可用C6H10O5表示。有关说法正确的是

A. b电极为该电池的负极
B. b电极附近溶液的pH增大.
C. a 电极反应式:C6H1005 -22e- +6H20 =6CO2↑ +22H+
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 泡沫灭火器的灭火原理:2A13+ +3 CO32-+3H2O= 2Al(OH)3↓+ 3CO2↑
B. 小苏打溶液呈碱性的原因:HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
C. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
D. 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com