
 ��û�к��٣�������ֻ��������Ϣ�������¡������Ⱥ���CO2����ʹ����ƽ�������ƶ������µ��DZ䱡��ʹũ�����ͳ������ܾ�����ʧ��
��û�к��٣�������ֻ��������Ϣ�������¡������Ⱥ���CO2����ʹ����ƽ�������ƶ������µ��DZ䱡��ʹũ�����ͳ������ܾ�����ʧ�� CO2��g�� CO2��l��
CO2��g�� CO2��l�� ��aq��+
��aq��+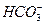 ��aq��
��aq�� 
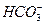 ��aq��
��aq�� H+��aq��+
H+��aq��+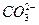 ��aq��
��aq��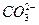 ��aq��
��aq�� CaCO3��s��
CaCO3��s��| A������ˮ | B��̼��ˮ | C������ˮ | D������ʯ��ˮ |
 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 Fe��SCN��2+ �����鷴Ӧ�Ƿ���������ӡ���֪��һ���¶��¸÷�Ӧ�ﵽƽ��ʱc��Fe3+��="0.04" mol/L��c��SCN����=0.1mol/L��c[Fe��SCN��2+]=0.68mol/L������¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
Fe��SCN��2+ �����鷴Ӧ�Ƿ���������ӡ���֪��һ���¶��¸÷�Ӧ�ﵽƽ��ʱc��Fe3+��="0.04" mol/L��c��SCN����=0.1mol/L��c[Fe��SCN��2+]=0.68mol/L������¶��¸÷�Ӧ��ƽ�ⳣ��K= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
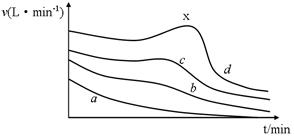
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��3
��3
 2
2 �����ڵ绯ѧ�ϳɰ��Ĺ����У�������ӦʽΪ_________��
�����ڵ绯ѧ�ϳɰ��Ĺ����У�������ӦʽΪ_________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 mZ(g) ��H="-a" kJ��mol-1(a��0)�����мס��������ݻ���ȵ���������������г���2mol X��1 mol Y,�ﵽƽ��ʱ�ų�����b kJ�����������г���1 mol X��0.5 mol Y,�ﵽƽ��ʱ�ų�����c kJ,��b��2c,��a��b�Ĵ�С��ϵ��m��ֵ����ȷ���ǣ� ��
mZ(g) ��H="-a" kJ��mol-1(a��0)�����мס��������ݻ���ȵ���������������г���2mol X��1 mol Y,�ﵽƽ��ʱ�ų�����b kJ�����������г���1 mol X��0.5 mol Y,�ﵽƽ��ʱ�ų�����c kJ,��b��2c,��a��b�Ĵ�С��ϵ��m��ֵ����ȷ���ǣ� ��| A��a="b" m="3" | B��a��b m��3 |
| C��a��b m��2 | D��a��b m��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2��g��+ I2��g��===2HI��g��������Ӧ�Ƿ��ȷ�Ӧ�� |
| B��NH4HCO3===NH3+H2O+CO2������Ӧ�����ȷ�Ӧ�� |
| C��2NO2===N2O4������Ӧ�Ƿ��ȷ�Ӧ�� |
| D��3O2===2O3 ������Ӧ�����ȷ�Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ʵ��������ˮ���ռ�����ʱ�ñ���ʳ��ˮ����ˮ�Լ����������ܽ� |
| B�����������������⻯��������ɵ�ƽ����ϵ��ѹ����ɫ���� |
| C��ʵ���ұ�������������Һʱ���뼸ö�����Է�ֹ�Լ����� |
| D���ڶ�������Ĵ�������Ӧ�У�ͨ������Ŀ�������߶��������ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g������ 2 s���룩���� C ��Ũ��Ϊ 0.6 mol��L-1 ���������м���˵����
2C��g������ 2 s���룩���� C ��Ũ��Ϊ 0.6 mol��L-1 ���������м���˵����| A���٢� | B���ۢ� | C���ڢ� | D���٢� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com