
(6分)已知A、B、C、D分别是由短周期元素原子组成的四种微粒,它们之间有如图所示的转变关系,且A是种含有18电子的微粒,C是一种含有10电子的微粒。请完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程
式
(2)若B、D属同主族的单质分子,写出C的化学式
(3)若B是一种含四核l8电子的分子,如果D是一种气态单质分子,B的结构简式为 ;
(4)若A、B均是含2个原子核的微粒,其中B中含有10个电子,D中含有18个电子,则A、B之间发生的离子反应方程式为
(5)若D是一种含有22电子的分子,则符合如图关系的A的物质有 (写出物质的化学式,如果是有机物则写相应的结构简式)。
(1) (1分) (2)
(1分) (2) (1分)
(1分)
(3) (1分)
(1分)
(4) (1分) (5)
(1分) (5)
 (2分)
(2分)
解析试题分析:(1)A是气态单质分子,18微粒,所以为F2,此框图为置换反应,所以D为氧气。方程式为 。
。
(2)C是10电子微粒,而B、D是同主族的单质分子,所以B为钠,D为氢气,C为水。
(3)B是一种四核电子分子,有18个电子,而D为气态单质,则D为氧气,B为双氧水。
(4)此反应为一个18电子微粒与一个10电子微粒反应生成另一个18电子微粒与另一个10电子微粒,符合此条件的只有 。
。
D为22电子,则D为CO2,C为10电子,则此反应为有机物完全燃烧生成水与二氧化碳。所以A是符合有18电子的有机物,可以为 、
、 等。
等。
考点:元素周期表、元素周期律
点评:本题比起上一题来说,综合性较小,但是推断过程难度稍微加大。在做题前要熟悉掌握10电子和18电子的微粒。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
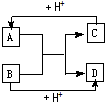 已知A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下图所示反应关系.
已知A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下图所示反应关系. 或
或
 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
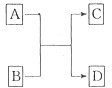 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题: →
→
 →
→


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com