
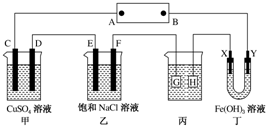
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:1 | |
| C. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 |
分析 A、根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极;
B、甲装置中C电极上氢氧根离子放电,D电极上铜离子放电,E电极上氯离子放电,F电极上氢离子放电,根据得失电子和生成物的关系式计算;
C、电镀时,镀层作阳极,镀件作阴极,电解质溶液中金属阳离子与阳极材料是相同的元素;
D、电解池中带正电荷的微粒向阴极移动,带负电荷的微粒向阳极移动.
解答 解:A、根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极,故A错误;
B、甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,所以(甲)、(乙)装置的C、D、E、F电极均有单质生成;生成1mol氧气需要4mol电子,生成1mol铜时需要2mol电子,生成1mol氯气时需要2mol电子,生成1mol氢气时需要2mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为1:2:2:2,故B错误;
C、若用(丙)装置给铜镀银,G应该是Ag,H是铜,电镀液是AgNO3溶液,故C错误;
D、丁装置中Y电极是阴极,如果Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷,故D正确.
故选D.
点评 本题考查了电解池原理,能正确判断电解池的阴阳极是解本题的关键,明确电泳现象证明了胶粒带电.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 天然气、太阳能、生物质能、风能、氢能均属于新能源 | |
| C. | 自发反应的熵一定增大,非自发反应的熵一定减小 | |
| D. | 常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气是绿色气体,不会污染空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
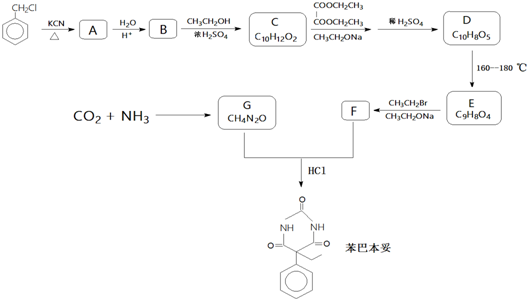
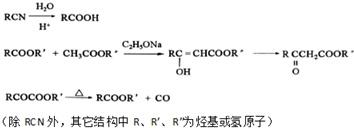
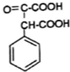 ;E→F的反应类型取代反应
;E→F的反应类型取代反应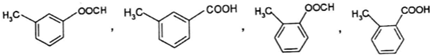 (其中一种).
(其中一种). 和苯环结构;
和苯环结构;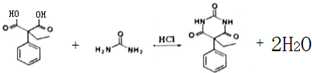 .
. )的合成路线(用流程图表示;无机试剂任选).
)的合成路线(用流程图表示;无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量浓硫酸溅到皮肤上,立即用氢氧化钠溶液冲洗 | |
| B. | 当出现CO中毒时,应立即将中毒者抬到室外空气新鲜处 | |
| C. | 将含硫酸的废液倒入水槽,用水冲入下水道 | |
| D. | 制取并收集氧气结束后,应立即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
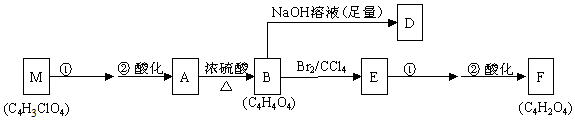
 +(2n-1)H2O .
+(2n-1)H2O . .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol | B. | 0.06mol | C. | 0.12mol | D. | 0.24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNacl 固体中含有NA个Na+ | |
| B. | 18gD2O和18gH2 O中含有的质子数均为10NA | |
| C. | 标准状况下2.24LH2O 含有的共价键数为0.2NA | |
| D. | 密闭容答中2molNO 与lmolO2充分反应,产物的分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com