
有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2。
(1)上述物质中,属于共价化合物的是 (填序号,下同),既存在离子键又存在极性键的是 。
(2)②号物质的电子式为 、用电子式表示⑥号物质的形成过程: 。
(10分)(1)⑤⑥;②③
(2)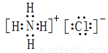 ;
;
【解析】
试题分析:(1)全部由共价键形成的化合物是共价化合物,所以属于共价化合物的是CO2和H2O,答案选⑤⑥;一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。如果是同一种非金属形成的共价键则是非极性键,如果是不同种非金属形成的共价键,则是极性键,所以既存在离子键又存在极性键的是氯化铵和氢氧化钠,答案选②③。
(2)氯化铵是离子化合物,电子式是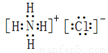 。水是由极性键形成的共价化合物,其形成过程可表示为
。水是由极性键形成的共价化合物,其形成过程可表示为 。
。
考点:考查化学键、共价化合物、电子式等
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。明确化学键的含义以及化学键与化合物关系是答题的关键,有利于培养学生的逻辑思维能力和规范答题能力。


科目:高中化学 来源: 题型:



| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 3 |
查看答案和解析>>
科目:高中化学 来源:必修二全优指导化学苏教版 苏教版 题型:058
经测定,乙醇的分子式是C2H6O.由于有机物普遍存在同分异构现象,推测乙醇的结构可能是下列两种之一.
①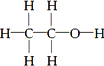
②
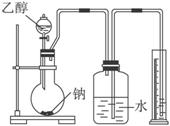
为测定其结构,应利用物质的特殊性进行定性、定量实验.现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四位同学直接利用下图给定装置进行实验确定乙醇的结构.

(1)学生甲得到一组实验数据,见下表:
根据以上数据推断乙醇的结构应为________(用①②表示),理由为________.
(2)同学乙分别准确称量4.60 g乙醇进行多次实验,结果发现以排开量筒内的水的体积作为生成的H2体积换算成标准状况后都小于1.12 L.如果忽略量筒本身及同学乙读数造成的误差,那么乙认为这可能是由样品中含有少量水造成的,你认为正确吗?________(填“正确”或“不正确”).如果你认为正确,请说明理由;如果你认为不正确,那么产生这种情况的原因应该是什么?________.
(3)同学丙认为实验成功的关键有下列几点,其中正确的是________.(填序号)
①装置气密性要良好 ②实验开始前准确确定乙醇的量 ③钠足量 ④广口瓶内水必须充满 ⑤氢气体积的测算方法正确、数据准确
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需知道的数据是.
(5)实验结束后,四名同学从乙醇的可能结构分析入手,对乙醇和钠的量的关系进行了讨论.如果乙醇的物质的量为n mol,那么对钠的物质的量的取值要求必须是_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
① ②
②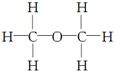
为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四位同学直接利用下图给定装置进行实验确定乙醇的结构。
(1)学生甲得到一组实验数据,见下表:
乙醇的物质的量/mol | 氢气的体积/L |
0.10 | 1.12(标准状况) |
根据以上数据推断乙醇的结构应为______________(用①②表示),理由为______________。
(2)同学乙分别准确称量
(3)同学丙认为实验成功的关键有下列几点,其中正确的是_______________。(填序号)
①装置气密性要良好 ②实验开始前准确确定乙醇的量 ③钠足量 ④广口瓶内水必须充满 ⑤氢气体积的测算方法正确、数据准确
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需知道的数据是____________。
(5)实验结束后,四名同学从乙醇的可能结构分析入手,对乙醇和钠的量的关系进行了讨论。如果乙醇的物质的量为n mol,那么对钠的物质的量的取值要求必须是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com