
| A. | 泡利 | B. | 洪特 | C. | J•K罗林 | D. | 鲍林 |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表得出三种酸电离平衡常数的大小关系为:HF>HClO>H2CO3(一级电离平衡常数) | |
| B. | 加热0.1mol•L-1NaClO溶液其pH,PH小于9.7 | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)═c(F-)>c(H+)=c(OH-) | |
| D. | 0.1 mol•L-1Na2CO3溶液中,存在的关系:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
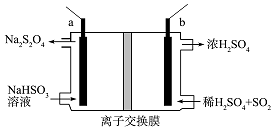 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )| A. | b电极应该接电源的负极 | |
| B. | 装置中所用离子交换膜为阴离子交换膜 | |
| C. | 电路中每转移1mole-消耗SO2的体积为11.2L | |
| D. | a电极的电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
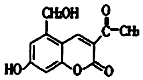 某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )| A. | 亮菌甲素的分子式为C12H12O5 | |
| B. | 1mol亮菌甲素最多能和2molNaOH反应 | |
| C. | 1mol亮菌甲素最多能和4 molH2发生加成反应 | |
| D. | 亮菌甲素在一定条件下可以与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “爆竹声中除旧岁,春风送暖入屠苏.”爆竹爆炸发生的是分解反应 | |
| B. | “甘之如饴”说明糖类均有甜味 | |
| C. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| D. | “忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
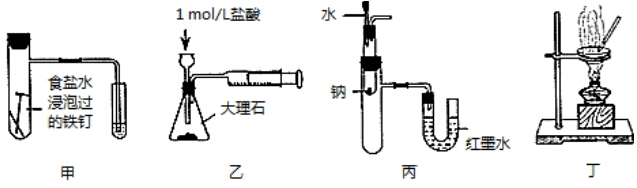
| A. | 用图甲装置验证铁发生析氢腐蚀 | |
| B. | 用图乙装置测定反应速率 | |
| C. | 用图丙装置验证Na和水反应的热效应 | |
| D. | 用图丁装置蒸干MgCl2溶液制备无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者小于后者 | |
| B. | 常温下,等浓度CH3COONa溶液的pH大于NaCN溶液的pH | |
| C. | 常温下,等体积、等浓度CH3COONa溶液的离子总数等于NaCN溶液的离子总数 | |
| D. | 反应CH3COOH+CN-?HCN+CH3COO-的化学平衡常数为2.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| B. | 等物质的量的OH-与烃基(-OH)所含电子数相等 | |
| C. | 惰性电极电解食盐水,若电路中通过NA个电子,则标况下阳极产生气体11.2L | |
| D. | 25℃时,pH=13的1.0LBa(OH)2溶液中含OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体 | |
| B. | 在CaF2晶体中,每个晶胞平均占有4个Ca2+ | |
| C. | 在金刚石晶体中,碳原子与碳碳键数之比为1:2 | |
| D. | 该气态团簇分子的分子式为EH或HE |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com