
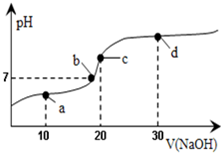
 20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )| A. | a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | ||
| C. | c点:c(H+)=c(CH3COOH)+c(OH-) | D. | d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.a点溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性;
B.根据电荷守恒及溶液的酸碱性进行判断;
C.c点时,溶液呈碱性;
D.d点为NaOH和CH3COONa的混合物,溶液呈碱性.
解答 解:A.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,所以c(H+)>c(OH-),溶液呈电中性,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,应有c(H+)=c(OH-),则c(Na+)=c(CH3COO-),所以溶液中离子浓度关系:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.c点时,溶液呈碱性,应有c(H+)<c(OH-),故C错误;
D.d点为NaOH和CH3COONa的混合物,且2c(NaOH)=c(CH3COONa),溶液呈碱性,醋酸根离子水解但水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确.
故选C.
点评 本题考查酸碱混合的判断和离子浓度大小比较,答题时注意a、b、c、d点溶液的组成,把握弱电解质的电离和盐类水解的特点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离程度 | B. | 醋酸的电离常数 | ||
| C. | 中和时所需NaOH的物质的量 | D. | CH3COOH的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2=V3 | B. | V1>V2>V3 | C. | V1=V2=V3 | D. | V1=V2<V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液中加入稀硝酸:SO32-+2H+═SO2↑+H2O | |
| B. | NH4HSO3溶液与少量的NaOH溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| C. | FeBr2溶液中通入足量的Cl2:4Fe2++4Br-+3Cl2═4Fe3++2Br2+6Cl- | |
| D. | 向碳酸氢钙溶液加入少量氢氧化钾溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸分子中均含有一OH,均可与NaOH反应 | |
| B. | 甲烷和乙烯均能使酸性的高锰酸钾溶液褪色 | |
| C. | 苯分子是一种单双键交替排列的特殊结构,所以既可发生取代又能加成反应 | |
| D. | 煤和石油均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com