
【题目】近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上。已知汽车尾气中的主要污染物为NOx、CO、超细颗粒(PM2.5)等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。根据下列示意图回答有关问题:
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
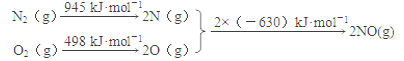
写出该反应的热化学方程式:_________________
(2)空燃比较易产生CO,有人提出可以设计反应2CO(g)===2C(s)+O2(g)来消除CO的污染。判断该设想是否可行,并说出理由:_____________________。
(3)在汽车上安装三元催化转化器可实现反应:
(Ⅱ)2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH <0 。若该反应在恒压的密闭容器中进行,则下列有关说法正确的是_______________
N2(g)+2CO2(g) ΔH <0 。若该反应在恒压的密闭容器中进行,则下列有关说法正确的是_______________
A.其他条件不变,增大催化剂与反应物的接触面积,能提高反应速率,使平衡常数增大
B.平衡时,其他条件不变,升高温度,逆反应速率增大,正反应速率减小
C.在恒温条件下,混合气体的密度不变时,反应达到化学平衡状态
D.平衡时,其他条件不变,增大NO的浓度,反应物的转化率都增大
(4)将NO和CO以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。以下说法正确的是__________。
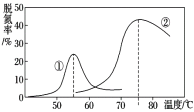
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.在该题条件下,两种催化剂分别适宜于55 ℃和75 ℃左右脱氮甲醇﹣空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图甲,
该燃料电池的电池反应式为 2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)
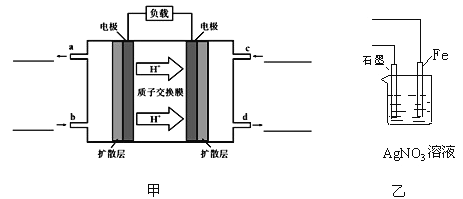
①负极的电极反应式为_______________,氧气从_______________(填b或c)口通入
②用该原电池电解AgNO3溶液,若Fe电极增重5.4g,则燃料电池在理论上消耗的氧气的体积为________mL(标准状况)
【答案】 N2(g)+O2(g)===2NO(g) ΔH =+183 kJ·mol-1 不合理。该反应焓增、熵减,任何条件下都不能自发进行或该反应ΔH>0,ΔS<0,则ΔG>0 C C ![]() c 280 mL
c 280 mL
【解析】(1)本题考查焓变的计算,△H=反应物的键能总和-生成物的键能总和=(945+498-630×2)kJ·mol-1=+183kJ·mol-1;(2)本题考查化学反应进行的方向,根据△G=△H-T△S,此反应是吸热反应,即△H>0,根据反应方程式,属于熵增,即△S>0,因此△G>0,不能自发进行,此设计不可行;(3)本题考查化学平衡常数、影响化学反应速率的因素、化学平衡状态的判断,A、化学平衡常数只受温度的影响,因此使用催化剂,化学平衡常数不变,故错误;B、升高温度,正逆反应速率都增大,故错误;C、组分都是气体,因此气体质量不变,恒压状态下,反应前气体系数大于反应后气体系数,因此气体体积是减小的过程,即当密度不再改变,说明反应达到平衡,故正确;D、NO也是反应物,增大NO的浓度,CO的转化率增大,但NO的转化率降低,故错误;(4)考查影响化学平衡的因素,A、催化剂对化学平衡的移动无影响,故错误;B、反应前后气体系数之和不相等,反应前的气体系数之和大于反应后,增大压强,平衡向正反应方向移动,脱氮率增加,故错误;C、催化效率最高,说明是适宜温度,根据图像,即55℃和75℃,故正确;(5)本题考查电极反应式的书写和电化学的计算,①负极应是通燃料的一极为负极,即通甲醇的一极为负极,根据质子移动的方向,左边电极为负极,右边电极为正极,因此电极反应式为CH3OH+H2O-6e-=CO2+6H+,氧气从b口通入;②Fe极质量增重,说明Fe作阴极,电极反应式为Ag++2e-=Ag,正极反应式为O2+4H++4e-=2H2O,因此有2Ag+~4e-~O2,因此氧气的体积为5.4×22.4×1000/(4×108)mL=280ml。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中不正确的是
A.锌、铜电极和稀硫酸溶液构成的原电池中铜是正极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜发生氧化反应
D.用电解法精炼粗铜时纯铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.pH<7的溶液一定呈酸性
B.在纯水中加入少量硫酸,可促进水的电离
C.虽然固体氯化钠不能导电,但氯化钠是电解质
D.Na2CO3溶液中,c(Na+)是c(CO32﹣)的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 在合成塔中加入3molH2与1molN2反应即可得到2molNH3
B. 工业上合成SO3时可加入过量空气以提高SO2的转化率
C. 利用Al、Mg、NaOH溶液、导线及电流计等可证明Al的金属活动性大于Mg的
D. 冰箱保存的食品不易变质,与化学反应速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合溶液,加入反应容器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60 ℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸与浓硝酸的混合酸时,操作注意事项是将__________注入到________ 里,并______________(填操作名称)。
(2)步骤③中,发生的化学反应方程式是
________________________________________________________________________。
为了使反应在50~60 ℃下进行,常用的方法是________________________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是__________。
(4)步骤④中粗产品用5% NaOH溶液洗涤的目的是____________。
(5)硝基苯是_______颜色________(填”固体,液体,气体”之一),_______(填”有,无”之一)毒,_____(填”可,难”之一)溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016北京]我国科技创新成果斐然,下列成果中获得诺贝尔奖的是
A.徐光宪建立稀土串级萃取理论
B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂
D.侯德榜联合制碱法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
CO | H2O | CO2 | H2 | |||
① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量_____________(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为_____________。
(3)计算容器①中反应的平衡常数K=_____________。某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正 V逆(填大于,小于或等于)
(4)下列叙述正确的是_____________(填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() Lv的叙述错误的是
Lv的叙述错误的是
A. 原子序数116 B. 中子数177 C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com