
| A. | 有大量SO32-溶液中:Na+、NH4+、SO42-、NO3- | |
| B. | 强碱性溶液中:NH4+、Ca2+、NO3-、Cl- | |
| C. | 强酸性溶液中:Cu2+、Mg2+、HCO3-、SO42- | |
| D. | 有大量Ba2+溶液中:K+、Ca2+、CO32-、SO32- |
科目:高中化学 来源: 题型:选择题
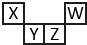 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )| A. | 最高正化合价:X<Y<Z | |
| B. | 原子半径:X<Y<Z | |
| C. | 气态氢化物的热稳定性:Z<W | |
| D. | 最高价氧化物对应水化物的酸性:X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2:电解饱和食盐水 | B. | O2:过氧化氢与二氧化锰混合 | ||
| C. | H2:锌粒和稀硝酸混合 | D. | NH3:氮气和氢气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与CO2反应 | D. | NaOH与HCl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的化学式为Fe2O3 | |
| B. | x=6 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | 每生成1mol Y,反应转移的电子总数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2═Ba2++2Cl- | B. | Fe2(SO4)3═Fe23++(SO4)32- | ||
| C. | HNO3═H++NO3- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c({CH}_{3}C{OO}^{-})}{c({CH}_{3}COOH)}$的值增大到原来的100倍 | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-═AlO2-+NH3•H2O+2BaSO4↓ | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com