
| ����1 | ���������Ƚ�������Ҫ�ɷ�CO��CH4��H2����SO2�ڸ����»�ԭ�ɵ������䲿���Ȼ�ѧ����ʽΪ�� 2CO��g��+SO2��g��=S��g��+2CO2��g����H=+8.0kJ•mol-1 2H2��g��+SO2��g��=S��g��+2H2O��g����H=+90.4kJ•mol-1 |
| ����2 | ��Na2SO3��Һ�������SO2��NaHSO3��Һ��Ȼ�������Һ���Ƶ�����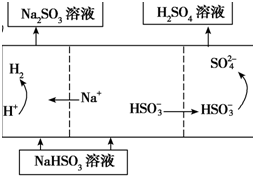 |
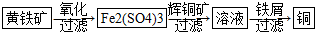
���� ��1����������ת����֪�������ͭ ������ͭ��������������ͭ������ͭ����������ԭ��Ӧ�����ж��Ķ���������ϸ��ұ���в������ж����壬������Ⱦ��С��������ͬʱ��ϸ��ұ�𡱳����������Դ��
��2����������ԭ��Ӧ�У��õ��ӻ��ϼ۽��͵ķ�Ӧ������������ʧ���ӻ��ϼ����ߵķ�Ӧ���ǻ�ԭ����
��3��ȼ������ָ��ȫȼ��1mol�����������ȶ�����Ĺ��̷ų������������ݸ�˹���ɺ��Ȼ�ѧ����ʽ����õ�S��g����O2��g����Ӧ����SO2��g�����Ȼ�ѧ����ʽ��
��4���������ʧȥ���ӣ�����������Ӧ�����ϼ����ߣ����â��з���2����β������ʼʱ���ݻ��ϼ۱仯�ж�������Ӧ���ʣ�д��������Ӧʽ��
��5����Ӧ��ΪFeS2��������ˮ��������ΪFe2��S04��3�����ᣬ���ݷ�Ӧ�����������д��ѧ��Ӧ����ʽ��
��6������FeS2�е���Ԫ����+2�۱���������Ϊ+3�ۣ���Ԫ����-1�۱�����Ϊ+6�ۣ���1molFeS2ʧȥ15mol���ӣ���1molO2����ԭʱ��4mol���ӣ����ݵ�ʧ�������غ�ͻ�ѧ����ʽ���㣻
��� �⣺��1����������ת����֪�������ͭ������ͭ��������������ͭ������ͭ����������ԭ��Ӧ�����ж��Ķ���������ϸ��ұ������������ܴ����Դ���ģ��������ж����壬������Ⱦ��С�����������ڼ�����Ⱦ��ͬʱ��ϸ��ұ�𡱳����������Դ����ƶ��β��Ŀ��ɸ��м�ֵ��
�ʴ�Ϊ���ܴ����Դ���ģ����ڼ�����Ⱦ���ƶ��β��Ŀ��ɸ��м�ֵ��
��2�����з�Ӧ2Cu2O+Cu2S=6Cu+SO2����Cu2S�ڷ�Ӧ��CuԪ�ػ��ϼ۽��ͣ�+1��0����SԪ�ػ��ϼ����ߣ�-2��+4������Cu2S�ڷ�Ӧ�м��������������ǻ�ԭ����Cu2O�ڷ�Ӧ��CuԪ�ػ��ϼ۽��ͣ�+1��0����OԪ�ػ��ϼ۲��䣬Cu2OΪ��������������������Cu2O��Cu2S��
�ʴ�Ϊ��Cu2O��Cu2S��
��3��CO��ȼ����283.0kJ•mol-1������ʽΪCO��g��+$\frac{1}{2}$O2��g���TCO2��g����H=-283.0kJ•mol-1�٣�2CO��g��+SO2��g��=S��g��+2CO2��g����H=+8.0kJ•mol-1�ڣ�
���١�2-�ڵã�S��g��+O2��g���TSO2��g����H=-574.0kJ•mol-1��
�ʴ�Ϊ��S��g��+O2��g���TSO2��g����H=-574.0kJ•mol-1��
��4�������������͵�Դ����������ʧȥ���ӣ�����������Ӧ�����NaHSO3��Һ���Ƶ����ᣬ��Ļ��ϼ����ߣ�����������HSO3-��Һʧȥ���ӱ���������SO42-���������缫��Ӧʽ�ǣ�HSO3-+H2O-2e-=SO42-+3H+��
�ʴ�Ϊ��HSO3-+H2O-2e-=SO42-+3H+��
��5����Ӧ��ΪFeS��������ˮ��������ΪFe2��S04��3�����ᣬ������Ӧ�Ļ�ѧ����ʽΪ4FeS2+15O2+2H2O $\frac{\underline{\;ϸ��\;}}{\;}$2Fe2��S04��3+2H2S04��
�ʴ�Ϊ��4FeS2+15O2+2H2O $\frac{\underline{\;ϸ��\;}}{\;}$2Fe2��S04��3+2H2S04��
��6������������4FeS2+15O2+2H2O $\frac{\underline{\;ϸ��\;}}{\;}$2Fe2��S04��3+2H2S04�����˺�Cu2S+10Fe3++4H2O$\frac{\underline{\;ϸ��\;}}{\;}$2Cu2++10Fe2++8H++S042-��������Fe+Cu2+=Cu+Fe2+��Fe+2H+=H2��+Fe2+�����ĵ�����¿���5��22.4VL�������������Ϊ20%�������������ʵ���Ϊ��$\frac{5��22.4VL��20%}{22.4L/mol}$=vmol��FeS2�е���Ԫ����+2�۱���������Ϊ+3�ۣ���Ԫ����-1�۱�����Ϊ+6�ۣ���1molFeS2ʧȥ15mol���ӣ���1molO2����ԭʱ��4mol���ӣ����ݵ�ʧ�������غ��֪��������n��FeS2��=$\frac{vmol��4}{15}$=$\frac{4}{15}$vmol������4FeS2+15O2+2H2O $\frac{\underline{\;ϸ��\;}}{\;}$2Fe2��S04��3+2H2S04��Cu2S+10Fe3++4H2O$\frac{\underline{\;ϸ��\;}}{\;}$2Cu2++10Fe2++8H++S042-��������ԭ���غ����ɵ���������n��Fe2+��=$\frac{4}{15}$vmol������n��Cu2+��=$\frac{4}{15}$vmol��$\frac{2}{10}$=$\frac{4}{75}$vmol�����ɵ��������ɵ�һ��Ӧ���ɵ�����͵ڶ���Ӧ���ɵ������Ӻͣ�����n��H+��=$\frac{4}{15}$vmol+$\frac{16}{75}$vmol=$\frac{36}{75}$vmol��������Fe+Cu2+=Cu+Fe2+��Fe+2H+=H2��+Fe2+�����ɵ���������Ϊ��һ�ڶ���Ӧ���ɵ���������$\frac{4}{15}$vmol������ͭ���ӷ�Ӧ�����ɵ���������$\frac{4}{75}$vmol�Լ��������Ӧ���ɵ���������$\frac{18}{75}$vmol���������ɵ�����������n��Fe2+��=$\frac{4}{15}$vmol+$\frac{4}{75}$vmol+$\frac{18}{75}$vmol=$\frac{42}{75}$vmol������ҺXml������c��Fe2+��=$\frac{n}{v}$=$\frac{\frac{42}{75}mol}{v��1{0}^{-3}L}$��
�ʴ�Ϊ��$\frac{\frac{42}{75}mol}{v��1{0}^{-3}L}$��
���� ���⿼����ұ��ͭ���ַ�����������ۣ�����ͭ���仯����������������̷�Ӧ�ǽ��Ĺؼ�����6�������Ǹ������ѵ㣬��Ŀ�ѶȽϴ�


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
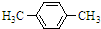 +Br2$\stackrel{FeBr_{3}}{��}$
+Br2$\stackrel{FeBr_{3}}{��}$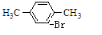 +HBr��
+HBr���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
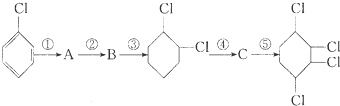
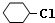 ��B��
��B��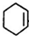 ��C��
��C��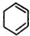 ��
��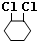 +2NaOH$��_{��}^{��}$
+2NaOH$��_{��}^{��}$ +2NaCl+2H2O��
+2NaCl+2H2O�� +2Cl2��
+2Cl2��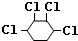 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
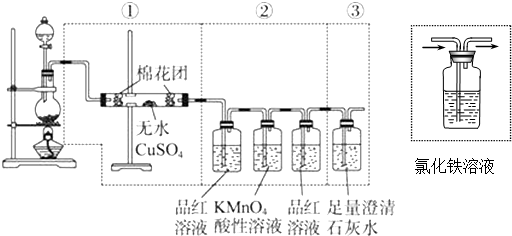
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǽ�����X��Y��Z | |
| B�� | �����������H3ZO4��H2YO4��HXO4 | |
| C�� | Ԫ�صĸ����ϼ۵ľ���ֵ��X��Y��Z��С | |
| D�� | ԭ�Ӱ뾶��X��Y��Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Fe | H2O��g�� | Fe3O4 | H2 | |
| ��ʼ/mol | 3.0 | 4.0 | 0 | 0 |
| ƽ��/mol | m | n | p | Q |
| Fe | H2O��g�� | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.11mol | B�� | 0.22mol | C�� | 0.16mol | D�� | 0.1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������п��Ӧ�ų��������� | |
| B�� | ����ʹ���ֱ���п��Ӧ�ų�������һ���� | |
| C�� | ������п��Ӧ����ʱ�䳤 | |
| D�� | ����ʹ���ֱ���п��Ӧ����ʱ��һ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com