
【题目】硫、铁及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价电子排布式为________,基态Fe原子未成对电子数为________个。
(2)团簇 中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
(3)工业上主要通过反应SO3+SCl2=SOCl2+SO2制备SOCl2(氯化亚砜),上述四种分子中,属于非极性分子的是________;SCl2分子空间构型为________形;SOCl2分子中心原子杂化方式是________。
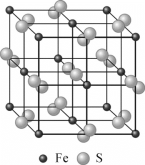
(4)黄铁矿的晶体结构如图所示,已知黄铁矿晶胞参数为a=0.5417nm,阿伏加德罗常数的值为NA。则黄铁矿的密度为________g·cm-3(列出计算式)。
【答案】3s23p4 4 3︰1 S和C SO3 V sp3 ![]()
【解析】
(1)主族元素的价电子排布式即最外层电子排布式,未成对电子数目看最外层电子的轨道排布式;
(2)列原子守恒、化合价的方程组可解;
(3)由中心原子的化合价与元素最高正价的关系可快速判断分子类型,由中心原子的价层电子对数可判断杂化类型,结合孤电子对数可判断空间构型;
(4)求密度公式:![]() 。
。
(1)S是第16号元素,位于元素周期表的第三周期第VIA族,故其价电子排布式为3s23p4,基态Fe原子价电子排布式为3d64s2,由3d轨道电子排布图可知,未成对电子数为4个;
(2)团簇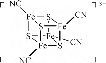 中,S、C、N的化合价依次为-2、+2、-3,则-CN的化合价为-1,设Fe2+数目为x,Fe3+数目为y,则有①x+y=4 ②2x+3y=9(化合价代数和等于所带电荷)。解得x=3,y=1。则Fe2+与Fe3+数目之比为3︰1。铁原子提供空轨,与C和S形成配位键;
中,S、C、N的化合价依次为-2、+2、-3,则-CN的化合价为-1,设Fe2+数目为x,Fe3+数目为y,则有①x+y=4 ②2x+3y=9(化合价代数和等于所带电荷)。解得x=3,y=1。则Fe2+与Fe3+数目之比为3︰1。铁原子提供空轨,与C和S形成配位键;
(3)SO3中硫元素的化合价为+6,硫原子最外层6个电子全部成键,属于非极性分子;SCl2价层电子对数=![]() =4,孤电子对数=4-2=2,则分子空间构型为V形;SOCl2价层电子对数=4,分子中心原子杂化方式是sp3;
=4,孤电子对数=4-2=2,则分子空间构型为V形;SOCl2价层电子对数=4,分子中心原子杂化方式是sp3;
(4)已知黄铁矿晶胞参数为a=0.5417nm=0.5417![]() cm,则黄铁矿的密度为:
cm,则黄铁矿的密度为:![]() g·cm-3。
g·cm-3。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
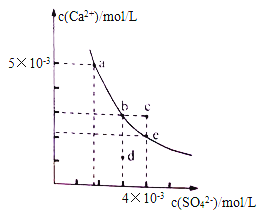
A. 曲线上任意一点的Ksp都相同
B. 在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由b点变化到c点
C. 蒸发水后,可使溶液由d点变化到b点
D. 常温下,CaSO4的Ksp的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中常含有少量的泥沙及氯化钙、氯化镁、硫酸盐等一些可溶性的杂质。粗盐的提纯实验操作步骤如图所示:
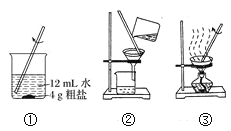
(1)请写出图中各步实验操作的名称②_____,③______。
(2)实验操作②的主要目的是______。
(3)实验操作①②③中都使用的仪器是_____,它在③中其作用是_____。
(4)通过上述实验操作,得到的精盐中可能含有的杂质是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成纤维、合成橡胶、合成塑料、合成乙醇的基本化工原料。回答下列问题:
(1)实验室快速制取少量乙烯可用乙烯利(![]() )与NaOH溶液反应制取。写出该反应的化学方程式为________(磷转化为磷酸正盐)。
)与NaOH溶液反应制取。写出该反应的化学方程式为________(磷转化为磷酸正盐)。
(2)乙烷裂解制备乙烯越来越受到石化企业的重视。已知部分热化学方程式如下:
Ⅰ.C2H6(g)=C2H4(g)+H2(g) △H1=+137kJ·mol-1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+42kJ·mol-1
Ⅲ.C2H6(g)+CO2(g)=C2H4(g)+CO(g)+H2O(g) △H3
①反应Ⅲ的△H3=________kJ·mol-1。
②若在1273K时,100kPa下反应(Ⅰ)达到平衡时,混合气体中C2H4、C2H6、H2的物质的量分别为0.047、0.006、0.047,则乙烯的分压为p(C2H4)=________kPa;平衡常数Kp=________(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
③恒温恒容密闭容器中进行的反应(Ⅱ),能说明已达到平衡状态的是________(填字母)。
a.压强不再随时间变化 b.混合气体密度不再随时间变化
c.v(H2)正=v(CO)逆 d.单位时间内断裂C=O的数目与断裂H-O的相等
④乙烷直接裂解以及与CO2耦合裂解可能发生的反应及平衡转化率(α)与温度(T)的关系分别如下图所示,已知:a.C2H6=C2H4+H2;b.C2H6+CO2=C2H4+CO+H2O;c.C2H6+2CO2=4CO+H2;d.2C2H6+CO2=C2H4+2CO+2H2+CH4;e.16C2H6+9CO2=14C2H4+12CO+12H2+6H2O+CH4。

下列说法正确的是________(填字母)。
a.600℃以下,反应a的趋势最大
b.CO2和C2H6耦合裂解有利于提高乙烷的平衡转化率
c.过量CO2和C2H6耦合高温裂解,可较好防止催化剂表面结炭
d.用合适的催化剂催化CO2和C2H6耦合裂解,可提高反应平衡常数
(3)以太阳能电池为电源,利用电解法也可实现CO2制备乙烯,其装置如图所示。电极a为电源的________(填“正极”或“负极”),生成乙烯的电极反应式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香化合物A为原料制备灭鼠剂氟鼠酮中间体(G)的一种合成路线如下:

回答下列问题:
(1)A的化学名称是________;A→B的试剂及反应条件依次是________。
(2)E→F的反应类型是________。
(3)D的结构简式为________。
(4)G中的含氧官能团名称为________。
(5)芳香化合物X是F的同分异构体,X能发生银镜反应和水解反应,核磁共振氢谱有4组峰且峰面积之比为6︰6︰1︰1,写出一种符合上述条件的X的结构简式:________。
(6)PES(聚丁二酸乙二醇酯)是一种可生物降解型聚酯,设计以1,2-二氯乙烷为初始原料制备PES的合成路线:________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,反应原理为CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50 molCH4和1.2 mol NO2,测得n(CH4)(单位:mol)随时间变化的有关实验数据如表所示。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50 molCH4和1.2 mol NO2,测得n(CH4)(单位:mol)随时间变化的有关实验数据如表所示。
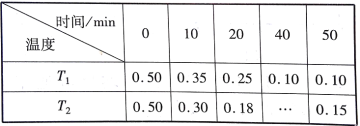
下列说法正确的是( )
A. T1温度下,0~20 min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T1<T2
C. 40min时,表格中T2应填的数据为0.18
D. 0~10 min内,CH4的降解速率T1> T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是

A. 该反应为吸热反应 B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同 D. 降低温度有利于该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:选择下图中的装置制备氢化锂(有些装置可重复使用):

(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
Ⅱ、制备氢化铝锂
1947年,Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)写出氢化锂与无水三氯化铝反应的化学方程式_________________________。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度
(4)按下图连接好装置后,检查装置气密性的操作是:_____________________。装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是__________________。

(5)在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com