
����Ŀ����һδ֪����ɫ��Һ��ֻ���ܺ������������е������֣�������ˮ���������H+��OH������H+��NH4+��K+��Mg2+��Cu2+��Al3+��NO3����CO32����SO42�� �� ��ȡ����100mL��Һ��������ʵ�飺 �ٵ�һ�ݼ�����AgNO3��Һ���а�ɫ����������
�ڵڶ��ݼ�����BaCl2��Һ���а�ɫ������������ϴ�ӡ������������Ϊ6.99g��
�۵�������εμ�NaOH��Һ����ó�����NaOH��Һ�������ϵ��ͼ��
��������ʵ�飬�����Ʋⲻ��ȷ���ǣ� ��
A.ԭ��Һһ��������H+��Cu2+��CO32��
B.����ȷ��ԭ��Һ�Ƿ���K+��NO3��
C.ʵ�����ӵ�NaOH��Ũ��Ϊ2molL��1
D.ԭ��Һȷ����Mg2+��Al3+��NH4+ �� ��n��Mg2+����n��Al3+����n��NH4+��=1��1��2
���𰸡�B
���������⣺��Һ����ɫ���ģ����Բ�������ɫ�����ӣ���Cu2+һ�������ڣ�ͨ��ͼ��֪���ڼ��������NaOH�Ĺ����У�һ��ʼ���г������ɣ�˵��������H+�����������ܽ⣬�ƶ�һ������Al3+��K+���ܺ���ѧ�������ʷ�Ӧ����������������жϣ�ֻ������ɫ��Ӧ�жϣ�����ȷ���Ƿ�K+���ٵ�һ�ݼ�����AgNO3��Һ���а�ɫ�����������ƶ�һ����CO32����SO42�������е�һ�֣���ͨ��ͼ��֪����Al3+�������Ӻ�̼������ӷ���˫ˮ�⣬���ܹ��棬�����ƶ�һ��������CO32����һ������SO42�����ڵڶ��ݼ�����BaCl2 ��Һ���а�ɫ������������ϴ�ӡ������������Ϊ6.99g���ƶ�����3��10��2molBaSO4 �� ����n��SO42����=3��10��2mol���۵�������εμ�NaOH ��Һ����ó�����NaOH��Һ�������ϵ��ͼ��ͨ��ͼ��֪���ڼ�������Ĺ������ƵĹ����У�һ��ʼ���г������ɣ�˵��������H+ �� ���������ܽ⣬�ƶ�һ������Al3+��ͼ������һ��ƽ̨��˵������OH��ʱ�������ɣ���NH4+ �� NH4++OH��=NH3H2O�������Һ���г�����˵����Һ�к�Mg2+ �� ͨ����ʵ�����ж��Ƿ���K+ �� A��������������֪��ԭ��Һһ��������H+��Cu2+��CO32�� �� ��A��ȷ��B��ԭ��Һȷ������Mg2+��Al3+��NH4+ �� ��ͼ��֪���������ʱ��������þ������������������n[Mg��OH��2]+n[Al��OH��3]=0.02mol��������Сʱ��Ϊ������þ����n[Mg��OH��2]=0.01mol����n[Al��OH��3]=0.02mol��0.01mol=0.01mol��������Ԫ���غ��֪n��Al3+��=n[Al��OH��3]=0.01mol������Al3++3OH��=Al��OH��3������OH��0.03mol������þԪ���غ��֪ԭ��Һ��n��Mg2+��=n[Mg��OH��2]=0.01mol������Mg2++2OH��=Mg��OH��2������OH��0.02mol�����ɳ��������ʱ��OH��0.05mol����ͼ��֪����Na0H25mL������c��Na0H ��= ![]() =
= ![]() =2molL��1������NH4++OH��=NH3H2O�����Կɵõ�NH4+�����ʵ���Ϊ0.01L��2molL��1=2��10��2mol����n��Mg2+����n��Al3+����n��NH4+����n��SO42�����T0.01mol��0.01mol��2��10��2mol��3��10��2mol=1��1��2��3���ɵ���غ��֪1��2+1��3+2��1��3��2����Ӧ����NO3�� �� ��B����C����ѡ��B�ļ����֪��ʵ�����ӵ�NaOH��Ũ��Ϊ2molL��1 �� ��C��ȷ��D����ѡ��B�ļ����֪��ԭ��Һȷ����Mg2+��Al3+��NH4+ �� ��n��Mg2+����n��Al3+����n��NH4+��=1��1��2����D��ȷ����ѡB��
=2molL��1������NH4++OH��=NH3H2O�����Կɵõ�NH4+�����ʵ���Ϊ0.01L��2molL��1=2��10��2mol����n��Mg2+����n��Al3+����n��NH4+����n��SO42�����T0.01mol��0.01mol��2��10��2mol��3��10��2mol=1��1��2��3���ɵ���غ��֪1��2+1��3+2��1��3��2����Ӧ����NO3�� �� ��B����C����ѡ��B�ļ����֪��ʵ�����ӵ�NaOH��Ũ��Ϊ2molL��1 �� ��C��ȷ��D����ѡ��B�ļ����֪��ԭ��Һȷ����Mg2+��Al3+��NH4+ �� ��n��Mg2+����n��Al3+����n��NH4+��=1��1��2����D��ȷ����ѡB��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4mol A�����2mol B������2L���ܱ������ڻ�ϣ�����һ�������·������·�Ӧ��2A��g��+B��g��2C��g��������2s����C��Ũ��Ϊ0.6molL��1 �� �������м���˵���� ��������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3molL��1s��1
��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6molL��1s��1
��2sʱ����A��ת����Ϊ70%
��2sʱ����B��Ũ��Ϊ0.7molL��1
������ȷ���ǣ� ��
A.�٢�
B.�٢�
C.�ڢ�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ϡ���ɫ��ѧ��˼����ǣ� ��
A.�������÷Ͼɵ��
B.��ȼ����ˮ������̫������ˮ��
C.��ʵ���ҵ��л���Һֱ�ӵ�����ˮ��
D.��ͨ�������ȡSO2����NaOH��Һ����β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ƶε����п������������ֳ������������ϣ��������������ɫ��������������������У� ��
A.������
B.����
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������γ��ص��ǣ� ��
A.��ҵ�ϴ�������ȼ�ϵ�ȼ��
B.��ҵ����ʹ������CO2��������
C.SO2�ڳ�����������ΪSO3
D.SO3��ˮ��Ӧ����H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⣮ 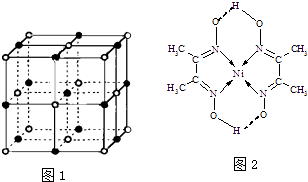
��1����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ����������ʾ��
������/kJmol��1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
Aͨ�����ۣ�BԪ�صĺ�������Ų�ʽΪ ��
��2��ʵ��֤����KCl��MgO��CaO��TiN��4�־���Ľṹ��NaCl����ṹ���ƣ���ͼ1��ʾ������֪3�����Ӿ���ľ��������������
���Ӿ��� | NaCl | KCl | CaO |
������/kJmol��1 | 786 | 715 | 3401 |
���4�����Ӿ��壨������NaCl���۵�Ӹߵ��͵�˳���� �� ����MgO������һ��Mg2+��Χ�������ڽ��ҵȾ����Mg2+������
��3�����������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�ã�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ��� ��
��4��ij�����ķ��ӽṹ��ͼ2��ʾ��������ڲ�����������ţ���
A.���Ӽ�
B.���Լ�
C.������
D.���
E.���
F.�Ǽ��Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A.ˮ����������Ϊ��Ӧ�Ľ���
B.ˮ�ܵ������������
C.ˮ����������һ�ֺܺõ��ܼ�
D.ˮ���ܾ���ʳ���л����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��2H2+O2=2H2O��
��1��Ϊ�˼ӿ�����Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��������ţ���ͬ���� A��ʹ�ô���B���ʵ����������Ũ��C���ʵ���߷�Ӧ���¶�D���ʵ����ͷ�Ӧ���¶�
��2�����������ֳư�������أ���صĵ��ҺΪ������Һ���ŵ�ʱ���ܷ�ӦΪ��Fe+Ni2O3+3H2O�TFe��OH��2+2Ni��OH��2�ٹ���ʱ��ظ���������缫���ϣ���
�ڸ����缫��Ӧʽ�� ��
�۵����·��ͨ��0.2mol����ʱ�����������ĵ�����������
��3����֪�÷�ӦΪ���ȷ�Ӧ����ͼ����ȷ��ʾ�÷�Ӧ�������仯���� �� 
��4����ضԻ�������Ⱦ�Ѿ�Խ��Խ�����ӣ������йص�ص�˵����ȷ���� A�����һ��Ƚ�С����ʹ��������Ҳ�������̫��Σ��
B����ز�����Ⱦ������Ҳ��Ⱦ����ˮ
C���Ͼɵ�ؿ���ֱ��ͨ��ȼ�յķ�ʽ��������
D���Ͼɵ�ؼ��д������������еĹ����ӡ������м۽������кܺõķ�չǰ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��8��17�գ��㶫���������ѵ�Ƿ�ʹ��Na2S2O4�Ƚ���ʳ�����ﵽ�������ã�Na2S2O4�׳Ʊ��շۣ���������Ư��ֽ�ź�ӡȾ��ҵ��ijѧϰС�������з����Ʊ������ʣ� �ٰѼ��ᣨHCOOH�����ڼ״���Һ���ٺ�������NaOH��Һ��������Һ��
����ȡSO2��ͨ��������Һ�У�һ��ʱ���ɻ�ñ��շۣ�
����֪��Na2S2O4��ˮ���ܽ�Ƚϴ��ڼ״����ܽ�Ƚ�С��
װ����ͼ1��ʾ
��1��Aװ���еķ�Һ©����Ϊ���������ƣ������ʣ�D��ʢ�ŵ��Լ�Ϊ ��
��2��Bװ�õ�����Ϊ��
��3��Cװ���ڷ����Ļ�ѧ��Ӧ����ʽΪ ��
��4������Cװ���в�Ʒʱ��ѡ��ͼ2װ��������ס��ҡ�����������ͬ���������Ҵ���װ��Ϊ �� 
��5��Na2S2O4�ڼ��Ի����г�ȥ��ˮ�е�CrO42����+4��S�Ļ������Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com