
| A.钠和冷水反应 Na+2H2O=Na++2OH?+H2↑ |
| B.金属铝溶于氢氧化钠溶液 Al+2OH?=AlO2?+H2 |
| C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ |
| D.铁跟稀硫酸反应:Fe+2H+=Fe2++H2 |
科目:高中化学 来源:不详 题型:填空题
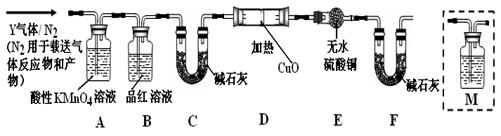

| A.蒸发皿 | B.石棉网 | C.漏斗 | D.烧杯 E.玻璃棒 F. 坩埚 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
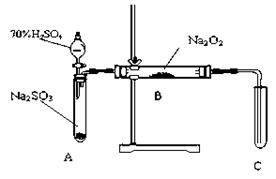
 请你完成装置改进的措施和理由:
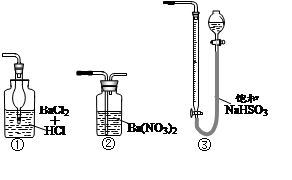
请你完成装置改进的措施和理由: ①措施:在A、B之间加一个干燥管,
①措施:在A、B之间加一个干燥管, 作用_______________________________________。
作用_______________________________________。 ②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶,
②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶, 作用_______________________。
作用_______________________。| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入 ,塞上单孔胶塞,将生成的气体通入 。 | 若 ,说明白色固体含有Na2SO3,则 成立,若无该现象, 则 成立。 |
| 步骤2:在步骤1反应后的溶液加入 。 | 若 ,则说明白色固体含Na2SO4。 结合步骤1的结论,则 成立,若无该现象,则 则 成立。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 操 作 |
| | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| | 欲证明溶液中含有SO42- | 滴入盐酸酸化的硝酸钡溶液 |
| | 欲证明溶液中含有S2- | 取少量溶液滴在醋酸铅试纸上看是否变黑 |
| | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| | 比较确定铜和镁的金属活动性强弱 | 用Pt作电极电解Mg(NO3)2、Cu( NO3)2混合液 |
| | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
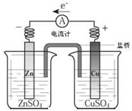
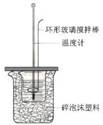
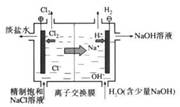

| A.铜锌原电池 | B.中和热测定装置 | C.离子交换膜法电解原理 | D.氨的制取装置 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
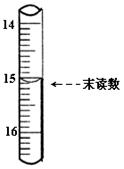
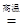 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。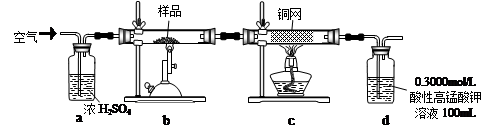
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com