
取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式: ,反应后得到的溶液呈 色。用此溶液分别做如下实验:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为 ,此反应属于 (填反应类型)。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体。
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中的液体产生丁达尔效应。这个实验可以用来区别 。
(4)用Fe(OH)3胶体进行下列实验:
①将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,这说明 ,这种现象称为 。
②向其中加入饱和(NH4)2SO4溶液发生的现象是 ,原因是 。
③向其中滴入过量稀硫酸,现象是 ,其原因是 。
④提纯此分散系常用的方法是 。
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:填空题
A.、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)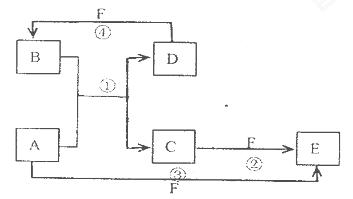
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电予数D是A的2倍,F的浓溶液与A D反应都有红棕色气体生成,则A为___________________,
反应④的化学方程式为____________________________________.
(2)若A为常见的金属单质,D F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________________.
(3)若A.D.F都是短周期非金属元素单质,且A.D所含元素同主族,A.F所含元素同周期,则反应①的化学方程式为________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示: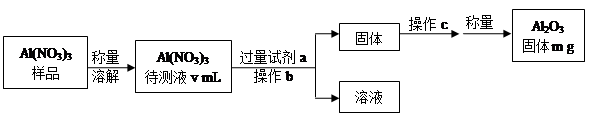
①加入试剂a后发生反应的离子方程式为 。
②操作b为 ,操作c为 。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示: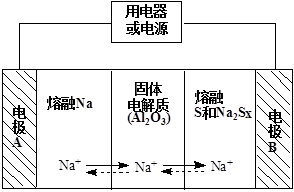
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示: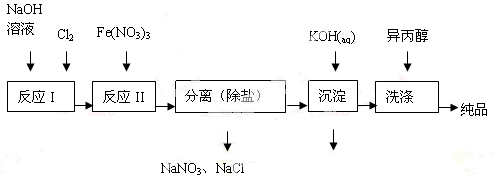
①洗涤粗品时选用异丙醇而不用水的理由是 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: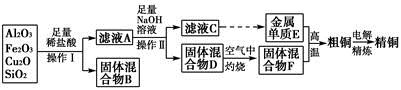
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为____________________________________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为__________________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
历史上金、银、铜主要是作为货币金属或装饰品被应用。
(1)金、银、铜常被作为钱币流通,从化学角度来看,主要是利用它们的 。
A.硬度适中
B.密度适中
C.在自然界里都可得到纯净的单质
D.不活泼性
(2)一位收藏者有一枚表面是黑色,且有少量绿色锈状物的货币,这肯定是 币,黑色物质是 ,形成这种物质的化学方程式为 ,绿色物质是 ,形成这种物质的化学方程式为 ,这枚金属币的真面目为 色。另外一枚是闪闪发光的黄色金属币,它肯定是 币,表面一直未被氧化的原因是 。
(3)不法分子有时用铜锌合金制成假金币行骗。下列方法中能有效鉴别其真假的是 。
A.观察颜色
B.查看图案
C.用手掂量轻重
D.滴一滴硝酸在币的表面,观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下: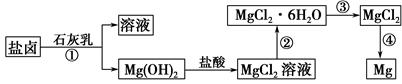
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是 。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图: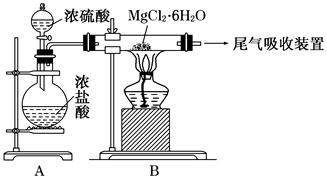
其中装置A的作用是 。
(4)写出过程④中发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。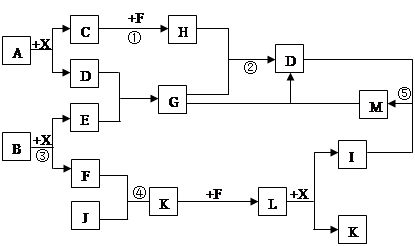
(1)写出化学式:A ,E ,L ;
(2)在反应①②③④⑤中属于氧化还原反应的是 ;
(3)反应③化学方程式为: ;
(4)写出下列离子方程式:反应② ;
G溶液与M溶液的反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下: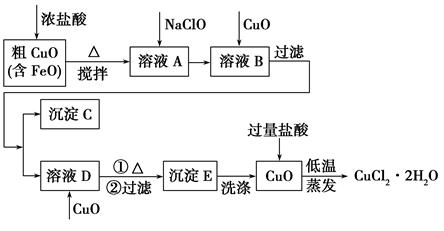
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com