
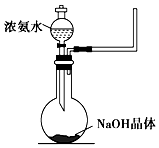
 氨气是一种重要的工业产品,也是一种重要的化工原料.为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
氨气是一种重要的工业产品,也是一种重要的化工原料.为研究氨气的制备及性质,某学习小组进行了下面的探究活动:分析 (1)氢氧化钙与氯化铵在加热条件下反应生成氯气、氯化钙和水;
(2)依据氨气溶于水的反应是一个可逆反应,氨气与水反应生成一水合氨,一水合氨为弱电解质,部分电离产生氨根离子与氢氧根离子,结合化学平衡移动的影响因素解答;
②假设一水合氨完全分解,则计算质量分数为34%的0.89 g•mL-1的浓氨水10 mL含有氨气的物质的量及标况下体积,据此解答.
解答 解:(1)氢氧化钙与氯化铵在加热条件下反应生成氯气、氯化钙和水,方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)氨气极易溶于水,氨气溶于水的反应是一个可逆反应,氨气与水反应生成一水合氨,氨气溶于水的反应是一个可逆反应,所以反应方程式为:NH3+H2O?NH3•H2O,NH3•H2O为弱电解质,在溶液中部分电离出铵根离子和氢氧根离子,其电离方程式为:NH3•H2O?NH4++OH-,即NH3+H2O?NH3•H2O?NH4++OH-,
a.氨水中的NH3•H2O 分解生成氨气与水,故a正确;
b.氨水中存在可逆反应:NH3•H2O?NH4++OH-,NaOH晶体溶于水电离产生氢氧根离子和钠离子,氢氧根离子浓度增大使该可逆反应的平衡向左移动,故b正确;
c.反应原理与铵盐、熟石灰制备氨气的反应原理不相同,氢氧化钙与氯化铵在加热条件下反应生成氯气、氯化钙和水为复分解反应,第二种制备氨气的方法中利用了一水合氨的分解反应,故c错误;
d.氢氧化钠溶于水放热,使NH3+H2O?NH3•H2O逆向移动,有利于氨气的逸出,故d正确;
故选:c;
②若10 mL 34%的0.89 g•mL-1的浓氨水中的NH3•H2O全部分解,生成的NH3的物质的量为10 mL×34%×0.89 g•mol-1÷35 g•mol-1=0.086 5 mol,标准状况下的体积为0.086 5 mol×22.4 L•mol-1=1.937 6 L,用体积为0.5 L的烧瓶收集时,因为最后一瓶收集不满,故最多只能收集满3个烧瓶;
故答案为:3.
点评 本题考查了氨气的实验室制备及有关计算,明确氨气的性质是解题关键,注意实验室简易制备氨气的方法和原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
| A. | 404 | B. | 230 | C. | 200 | D. | 260 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:B>X | |
| B. | B、X、Y的原子半径大小顺序为:X>Y>B | |
| C. | A的最高价氧化物对应的水化物的酸性强于Y的 | |
| D. | B分别与X、Y形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| B. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| C. | 向1L0.3mol•L-1NaOH溶液中通入0.2molCO2,溶液中CO32-和HCO3-的数目均为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=0.1 mo1•L-1 | B. | c(CO32-)>c(OH-) | ||
| C. | c(HCO3-)>c(CO32-) | D. | c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com