
【题目】高纯硝酸锶[Sr(NO3)2]可用于制作红色烟火、光学玻璃、电子管阴极材料等。由工业级硝酸锶(含有硝酸钡、硝酸钙等杂质)提取高纯硝酸锶的流程如下:

(1)滤液1中的主要溶质是___________(填化学式)。
(2)相对于水洗,滤渣1用浓硝酸洗涤的优点是________________________________。
(3)滤液2中过量的铬酸洗液被N2H4还原产生Cr3+和一种不污染环境的气体。该反应的离子方程式为______________________________________。
(4)滤渣3的主要成分是_____(填化学式);滤液3中c(Cr3+)=_____mol/L(常温下Ksp[Cr(OH)3]=6.3×10-31)。
(5)操作X为_____________;Sr(NO3)2·nH2O转化为高纯硝酸锶的过程温度要控制在100℃,目的是_________________。
(6)为测定Sr(NO3)2·nH2O的数值n,将7.44g Sr(NO3)2·nH2O晶体在100℃加热至恒重为6.36g的高纯硝酸锶。计算得n=______(M[Sr(NO3)2]=212g/mol)。
【答案】 Ca(NO3)2 HNO3 降低Sr(NO3)2(或硝酸盐)的溶解度,减少损失 2Cr2O72-+3N2H4+16H+==4Cr3++3N2↑+14H2O Cr(OH)3 6.3×10-13 蒸发浓缩、冷却结晶、过滤、洗涤或结晶、过滤、洗涤 防止Sr(NO3)2分解 2
【解析】试题分析:本题以硝酸锶的提纯为依托,主要考查方程式的书写、溶度积的计算、晶体的制备方法等基础知识,考查考生对工业流程的综合分析能力、运用化学知识解决实际问题的能力和计算能力。
(1)流程中Sr元素一直存在于被处理的物质中,且Ba元素在用过量的铬酸洗液处理时才生成钡的化合物沉淀,所以工业级Sr(NO3)2第一步用浓硝酸处理时,Ca(NO3)2溶解在浓硝酸中,而Sr(NO3)2和Ba(NO3)2则沉淀在浓硝酸中。答案:Ca(NO3)2、HNO3。(2)滤渣1需要洗涤的是固体表面浓硝酸中的Ca(NO3)2,而Sr(NO3)2和Ba(NO3)2易溶于水难溶于浓硝酸,因此水洗容易造成Sr(NO3)2的损失。正确答案:降低Sr(NO3)2溶解度,减少损失。(3)滤渣1经过浓硝酸洗涤除去残留中的Ca(NO3)2后,加水溶解后得到Sr(NO3)2、Ba(NO3)2的混合溶液(含有少量HNO3),再加过量铬酸洗液“沉钡”并分离后,滤液中主要含有Sr(NO3)2和过量的铬酸。因此,滤液2中过量的铬酸洗液被N2H4还原产生Cr3+和一种不污染环境的气体,这种气体是N2H4被Cr2O72-氧化生成的N2,由此得到该反应为:Cr2O72-+N2H4→Cr3++N2,注意到反应前溶液呈酸性,配平之后的反应为:2Cr2O72-+3N2H4+16H+=4Cr3++3N2↑+14H2O。正确答案:2Cr2O72-+3N2H4+16H+=4Cr3++3N2↑+14H2O。(4)调节溶液的pH后除去沉淀可以得到Sr(NO3)2,因此该过程中生成Cr(OH)3沉淀。![]() ,解得
,解得![]() 。正确答案:Cr(OH)3 、6.3x10-13。(5)得到的纯净的Sr(NO3)2溶液后,由该溶液制取硝酸锶晶体首先需要蒸发浓缩,但是为了防止硝酸锶水解,需要先加入浓硝酸,然后再冷却结晶、过滤、洗涤、干燥即可得到所需晶体。同时由于硝酸盐的不稳定性,加热过程中温度不宜过高,以防止硝酸锶分解。正确答案:蒸发浓缩、冷却结晶、过滤、洗涤;防止Sr(NO3)2分解。(6)Sr(NO3)2·nH2O
。正确答案:Cr(OH)3 、6.3x10-13。(5)得到的纯净的Sr(NO3)2溶液后,由该溶液制取硝酸锶晶体首先需要蒸发浓缩,但是为了防止硝酸锶水解,需要先加入浓硝酸,然后再冷却结晶、过滤、洗涤、干燥即可得到所需晶体。同时由于硝酸盐的不稳定性,加热过程中温度不宜过高,以防止硝酸锶分解。正确答案:蒸发浓缩、冷却结晶、过滤、洗涤;防止Sr(NO3)2分解。(6)Sr(NO3)2·nH2O![]() Sr(NO3)2+nH2O。既晶体的物质的量与无水硝酸锶的物质的量相等,所以
Sr(NO3)2+nH2O。既晶体的物质的量与无水硝酸锶的物质的量相等,所以![]() ,解得n=2。正确答案:2。
,解得n=2。正确答案:2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业合成氨的简易流程如下图所示:
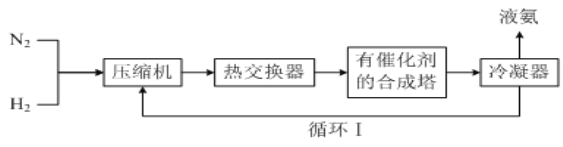
(1)通过循环Ⅰ可利用的气态物质是_______。
a.催化剂 b.只有N2 c.只有H2 d.N2和H2
(2)液氨常用作制冷剂,理由是___________________________________________________。
(3)互为同主族的N、P、As元素可以分别形成NH3 、PH3、AsH3,它们热稳定性的强弱关系为__________,运用相关理论解释结论:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,此溶液50mL正好与50mL0.4mol/L的AgNO3溶液完全作用。由上述数据计算
(1)4.06g的MgCl2·xH2O物质的量______。
(2)式中x的数值______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为____________(填字母),
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应_________________。
(3)电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:
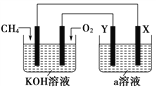
①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是____________________________________。
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是____________________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol CuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年科学工作若研究的两项最新成果如下:
I.4-一二甲氨基吡啶( )能高效催化醋酸酐和磺胺的反应。
)能高效催化醋酸酐和磺胺的反应。
II.钙钛矿制作的一种新材料推进了人工光合作用的进程。
请回答以下问题:
(1)基态钛原子的价电子排布式为_____________________。
(2)①构成4—二甲氨基吡啶分子的各原子电负性由大到小的顺序为_____________,其中元素第一电离能最大的是_________________。
②1mol4—二甲氨基吡啶分子中所含σ键的数目为_____________,其中C原子的杂化形式为____________。(3)乙酰氯(CH3COCl)和乙酸钠(CH3COONa)反应可以制备醋酸酐。这两种反应物中熔点更高的是_____,原因是_______________________________。
(4)自然界中除钙钛矿外,碳酸钙、硫酸钙也都是钙元素形成的常见物质。请比较键角的大小:CO32-_____SO42-(填“>”“<”或“=”),推断依据是_________________________________。
(5)钙钛矿有多种晶胞结构,其中一种晶胞结构如图所示
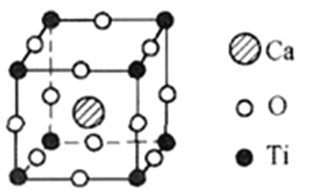
①此钙钛矿晶胞中,Ca2+周围距离最近且相等的Ca2+个数为__________________________。
②已知该晶胞的密度为d g/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数a=_______pm。(写出表达式,不需要进行计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的粒子浓度关系正确的是( )
A. 一定物质的量浓度的Na2S溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-)
B. 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
C. pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 25℃时,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液pH=4.75,c(![]() )+c(
)+c(![]() )=c(CH3COOH)+c(H+)
)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是______,原子数之比是______,质量之比是______,密度之比是______
(2)下列所给出的几组物质中:含有分子数最多的是_________;含有原子数最多的是_________;标准状况下体积最大的是____________。
① 1gH2; ② 2.408×1023个CH4 ;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是_________________(用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com