


科目:高中化学 来源: 题型:

| 实验记录 | 实验分析或实验结论 | |
| 现象 | 硬质玻璃管内物质由绿色变为红棕色 | 说明生成的物质有 |
| 干燥管内物质颜色由白色变为 | 说明生成的物质有 | |
数据 | 称取绿矾样品质量11.12g | |
| C装置增重1.28g | 说明生成SO2 | |
| A装置中生成白色沉淀4.66g | 说明生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱性溶液中:Na+、CO32-、SO32-、K+ |
| B、石蕊呈红色的溶液:ClO-、Na+、SO32-、Cl- |
| C、PH>7的溶液中:Mg2+、Br-、K+、Al3+ |
| D、加入Fe能放出H2的溶液中:Cl-、Mg2+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:
物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:| 阳离子 |
| ||
| 阴离子 | OH-、CH3COO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按如图所示的装置进行实验:
按如图所示的装置进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:
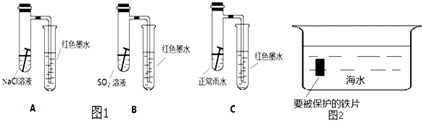
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.
物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al能放出H2的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| B、能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- |
| C、无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| D、常温下,在c(H+)/c(OH-)=1×10-12的溶液中:Fe2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com