
分析 Ⅰ.硫酸钡不溶于酸和水,钡离子有毒;
Ⅱ.BaCO3的溶解平衡:BaCO3?Ba2++CO32-,H+能与CO32-反应生成水和二氧化碳,促进溶解平衡正向移动;
Ⅲ.(1)含有相同的离子能抑制硫酸钡的溶解,难溶物质向更难溶物质进行转化,硫酸根离子或钡离子浓度越大,硫酸钡的溶解度越小;
(2)根据硫酸钡的溶度积常数计算硫酸根离子和钡离子浓度;
(3)先计算混合溶液中氢氧根离子浓度,再根据离子积公式计算氢离子浓度,从而确定溶液的pH值.
解答 解:Ⅰ.BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒,所以常用BaSO4做内服造影剂,故答案为:BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒;
Ⅱ.硫酸钡不溶于水和酸,但胃酸可与CO32-反应生成水和二氧化碳,使CO32-浓度降低,从而使平衡BaCO3(s)?Ba2+(aq)+CO32-(aq) 向溶解方向移动,使Ba2+浓度增大,且Ba2+有毒,所以不能用碳酸钡代替硫酸钡,反应离子方程式为:BaCO3+2H+═Ba2++H2O+CO2↑,
故答案为:BaCO3遇到胃酸生成Ba2+会使人中毒,反应离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑;
Ⅲ.(1)根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的浓度,所以硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:③>①>④>②;硫酸钡溶液中加入硫酸根离子和钡离子都会导致硫酸钡的沉淀溶解平衡逆移,硫酸钡的溶解度减小,硫酸根离子或钡离子浓度越大,硫酸钡的溶解度越小,所以BaSO4的溶解度的大小顺序:①>④>③>②,
故答案为:A;C;
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)=$\frac{Ksp}{c(B{a}^{2+})}$=$\frac{1.1×1{0}^{-10}}{0.2}$=5.5×10-10mol/L,②中c(Ba2+)=$\frac{1.1×1{0}^{-10}}{0.5}$=mol/L=2.2×10-10mol/L,
故答案为:5.5×10-10mol/L;2.2×10-10mol/L;
(3)40mL 0.2mol•L-1的Ba(OH)2溶液和40mL 0.1mol•L-1的H2SO4溶液中混合后溶液中c(OH-)=$\frac{(0.2-0.1)mol/L×2×0.04L}{0.04L×2}$=0.1mol/L,则c(H+)=10-13 mol/L,所以pH=13,
故答案为:13.
点评 本题考查难溶电解质及酸碱混合,为高频考点,把握溶解平衡、Ksp计算、酸碱混合时pH计算等为解答的关键,侧重分析与应用能力的考查,注意化学反应原理的应用,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 该气体的物质的量为m/M mol | |
| B. | 该气体在标准状况下的体积为22.4m/M L | |
| C. | 该气体中所含的原子总数为mNA/M个 | |
| D. | 该气体溶于1L水中(不考虑发生反应),所得溶液的物质的量浓度为m/M mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 月饼中放置用小袋包装的生石灰防止月饼氧化变质 | |
| B. | 用米汤来检验食用碘盐中的碘酸钾(KIO3) | |
| C. | 甘蔗可变成酒精 | |
| D. | 用催化剂将水变成油 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于有热量放出的反应的是②③ | B. | 属于化合反应的是①② | ||
| C. | 属于有化合价变化的反应是④⑤ | D. | 属于复分解反应的是③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Mg2+、H+、Zn2+、SO42- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | MnO4-、K+、H+、SO42- | D. | K+、NO3-、OH-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
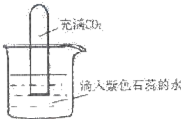 如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )| A. | ①② | B. | ①④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com