
| A. | 2个 | B. | 4个 | C. | 5个 | D. | 7个 |
分析 ①Fe3+与S2-能发生氧化还原反应;
②氯化镁中的镁离子易水解,在酸性环境下可以抑制水解;
③Na2CO3在溶液中水解生成氢氧根离子和碳酸氢根离子;
④已知:AgCl(s)?Ag+(aq)+Cl-(aq),加水稀释平衡右移,c(Ag+)不变;
⑤HCO3-和AlO2- 在溶液中会反应生成氢氧化铝沉淀和碳酸根离子;
⑥NaHSO3溶液显酸性,离子方程式中不能用氢氧根离子;
⑦醋酸是弱酸,加水稀释时醋酸的电离被促进;
⑧NaHSO3溶液中加入少量NaOH固体,NaHSO3与NaOH反应生成Na2SO3.
解答 解:①Fe3+具有较强的氧化性,S2-具有较强的还原性,Fe3+与S2-能发生氧化还原反应,所以Fe3+与S2-因发生氧化还原反应而不共存,故错误;
②氯化镁中的镁离子易水解,加热溶液促进水解,所以MgCl2溶液蒸干后得Mg(OH)2固体,在酸性环境下可以抑制水解,所以想要得到MgCl2固体应通入HCl的气流,故错误;
③Na2CO3在溶液中水解生成氢氧根离子和碳酸氢根离子,阴离子数目增加,所以将0.1mol的Na2CO3溶于水中,形成溶液中阴离子总数大于0.1NA,故错误;
④已知:AgCl(s)?Ag+(aq)+Cl-(aq),加水稀释平衡右移,饱和溶液中溶解度不变,所以c(Ag+)不变,故错误;
⑤HCO3-和AlO2- 在溶液中会反应生成氢氧化铝沉淀和碳酸根离子,所以HCO3-和AlO2- 不能大量共存,故错误;
⑥NaHSO3溶液显酸性,离子方程式中不能用氢氧根离子,所以将I2加入NaHSO3溶液中发生反应:HSO3-+I2+H2O=SO42-+2I-+3H+,故错误;
⑦盐酸是强酸,完全电离,将pH=2的盐酸稀释到pH=5时,稀释后溶液的体积是原来体积的1000倍;而醋酸是弱酸,加水稀释时醋酸的电离被促进,故同样是稀释至溶液的体积是原来体积的1000倍的时候,溶液的pH小于5,故要想也稀释至pH=5,故均稀释到pH=5,醋酸加水量大,故正确;
⑧NaHSO3溶液中加入少量NaOH固体,NaHSO3与NaOH反应生成Na2SO3,所以NaHSO3溶液中加入少量NaOH固体,$\frac{c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$将增大,故正确.
故选A.
点评 本题考查了盐酸的水解、氧化还原反应、离子共存、溶解平衡、电离平衡,题目涉及的知识点较多,侧重于反应原理的应用的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法 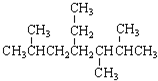 ,的名称为2,5,6-三甲基-4-乙基庚烷 ,的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| D. | 苯酚为无色晶体,常因为氧化呈粉红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
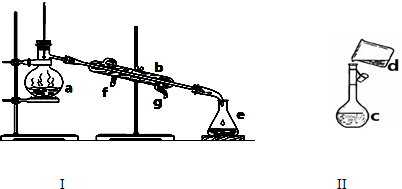
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 塑料、橡胶和纤维一定都是合成高分子材料 | |
| B. | 蔗糖不是高分子化合物,其水解产物能发生银镜反应 | |
| C. | 某烃类的混合气体跟Cl2混合光照,有油状液滴生成,说明混合气体肯定含有甲烷 | |
| D. |  分子中所有原子不可能都共平面. 分子中所有原子不可能都共平面. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+>MnO4->Cl2>Cu2+ | B. | MnO4->Cl2>Fe3+>Cu2+ | ||
| C. | Cl2>MnO4->Fe3+>Cu2+ | D. | Cu2+>Cl2>MnO4->Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com